 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Электронный курс лекций 4 страница
|
|
Чаще всего в радиометрических измерениях используют сцинтилляционные счетчики, обладающие рядом достоинств:
- они универсальны с точки зрения возможности регистрации ионизирующих излучений практически любых видов;
- дают возможность измерять энергию исследуемых частиц или квантов; обладают высокой разрешающей способностью и высокой эффективностью регистрации γ-излучения (до нескольких процентов).
Современный сцинтилляционный счетчик состоит из сцинтиллятора – вещества, способного испускать видимое излучение под действием заряженных частиц, и фотоэлектронного умножителя (ФЭУ), в котором энергия световых вспышек (сцинтилляции) преобразуется в импульсы электрического тока.
Приборы отечественного производства для радиационной разведки и дозиметрического контроля (ДП-5В, СРП-68-01, ДП-100, РКБ-4, КРБ-1) широко используются для контроля пищевых продуктов и питьевой воды.
1. Что такое радиоактивность вещества?
2. Что называется периодом полураспада?
3. Какие единицы измерения величин используются в радиометрическом методе анализа?
4. Какие приборы используются для обнаружения и измерения радиоактивных излучений?
7 Хроматографические методы анализа
Методики, основанные на использовании хроматографических методов разделения, довольно разнообразны и позволяют успешно исследовать практически любые пищевые продукты.
Благодаря высокому уровню развития экспериментальной техники и инструментального оснащения современные хроматографические методы позволяют с большой степенью точности и воспроизводимости решать сложные аналитические задачи, стоящие перед работниками лабораторий контроля качества пищевых продуктов, полуфабрикатов и сырья. В последние годы вследствие усовершенствования хроматографического метода были достигнуты высокая эффективность, значительная скорость разделения, что позволило использовать его и как микроаналитический метод.
(1) Адсорбционная хроматография – хроматография, проводимая за счет адсорбционного равновесия между неподвижной твердой и подвижной жидкой фазами.
(2) Адсорбционная хроматография газожидкостная – хроматография, проводимая за счет равновесного распределения между неподвижной жидкой и подвижной газовой фазами.
(3) Адсорбционная хроматография ионообменная – хроматография, проводимая за счет равновесия между ионообменной смолой и электролитом (подвижная фаза).
(4) Адсорбционная хроматография на бумаге – хроматография, проводимая за счет равновесного распределения между неподвижной жидкой и подвижной жидкой фазами.
(5) Аффинная хроматография – хроматография, проводимая за счет равновесного связывания макромолекулы с молекулой малой, по отношению к которой она проявляет высокую специфичность.
(6) Проникающая хроматография – хроматография, проводимая за счет равновесия между жидкой фазой на внутренней и внешней поверхностях пористой структуры или «молекулярного сита».
(7) Хроматография – метод, основанный на разделении сложных смесей на составные компоненты между двумя несмешивающимися фазами, из которых одна подвижная, а другая неподвижная.
(1) Внутренний стандарт – соединение, которое по физическим свойствам очень близко к исследуемому, и при хроматографировании движется вдоль колонки.
(2) Временем удерживания – время (температура, скорость пропускания газа-носителя и т. д.) прохождения анализируемого соединения через колонку, является постоянной величиной.
(1) Гель-фильтрация – разделение веществ при помощи гелей, основанное на разделении молекул по размерам при пропускании через плотное молекулярное сито.
7.1 Классификация хроматографических методов анализа
Хроматография (7) основана на разделении сложных смесей на составные компоненты между двумя несмешивающимися фазами, из которых одна подвижная, а другая неподвижная.
Существенным признаком хроматографического процесса является его динамический характер. В ходе процесса происходит перемещение подвижной фазы, содержащей анализируемую пробу, через неподвижную фазу. Причем взаимодействие «сорбция–десорбция» повторяется многократно, что обусловливает высокую эффективность хроматографического разделения.
Подвижная фаза может быть жидкой, твердой или представлять собой смесь жидкой или газообразной фаз и обычно перемещается по неподвижной фазе или пропускается через нее. По характеру разделения хроматографические методы анализа делятся на 4 группы:
адсорбционная хроматография (1) – за счет адсорбционного равновесия между неподвижной твердой и подвижной жидкой фазами;
распределительная хроматография и ее разновидности:
- на бумаге (4) – за счет равновесного распределения между неподвижной жидкой и подвижной жидкой фазами;
- в тонком слое;
- газожидкостная (2) – за счет равновесного распределения между неподвижной жидкой и подвижной газовой фазами;
- ионообменная (3) – за счет равновесия между ионообменной смолой и электролитом (подвижная фаза);
- проникающая хроматография (6) – за счет равновесия между жидкой фазой на внутренней и внешней поверхностях пористой структуры или «молекулярного сита»;
- аффинная хроматография (5) – за счет равновесного связывания макромолекулы с молекулой малой, по отношению к которой она проявляет высокую специфичность.
7.2 Адсорбционная хроматография
Разделение при адсорбционной хроматографии основано на различной адсорбируемости компонентов анализируемой смеси на адсорбенте. Эти свойства в основном определяются молекулярной структурой соединений. Вещество с более высоким коэффициентом распределения передвигается по поверхности адсорбента с большей скоростью. Если соединения окрашены, то при их разделении можно видеть окрашенные полосы (рис.7.1).

Рисунок 7.1 – Этапы хроматографического разделения на колонке:
а – поступление смеси на стартовую точку; б – опережение одного компонента другим; в – появление на выходе
Разделяемую пробу можно собрать в виде фракций пропусканием соответствующего растворителя через колонку, а затем производить анализ. Эффективность разделения во многом зависит от правильного выбора адсорбента.
Адсорбенты, применяемые в колоночной хроматографии, представлены в таблице 7.1.
Таблица 7.1 – Адсорбенты в колоночной хроматографии
| Адсорбент | Разделяемые соединения |
| Силикагель | Аминокислоты, углеводы, жирные кислоты, липиды, эфирные масла, неорганические катионы и анионы, алкалоиды |
| Оксид алюминия | Витамины, аминокислоты, пищевые красители, фенолы, алкалоиды, каротиноиды, стероиды |
| Целлюлоза | Аминокислоты, пищевые красители, нуклеотиды |
| Крахмал | Аминокислоты |
| Сефадекс | Белки, аминокислоты |
| Целлюлоза ионообменная | Нуклеотиды |
7.3 Распределительная хроматография: на бумаге, в тонком слое, газожидкостная и ионообменная
Распределительная хроматография осуществляется на колонках (газожидкостная и колоночная хроматография) либо на специальной хроматографической бумаге (распределительная хроматография на бумаге).
Хроматографическая бумага обладает свойством задерживать воду между волокнами. Эту воду можно рассматривать как один из растворителей (неподвижная фаза). Если бумагу поместить в слой неводного растворителя, то под воздействием капиллярных сил неводный растворитель (подвижная фаза) будет перемещаться и молекулы анализируемого вещества, предварительно нанесенного на хроматографическую бумагу, будут распределяться между фазами в соответствии с их коэффициентом распределения Rf. Каждое вещество характеризуется своей величиной Rf
В идеальном случае Rf определяется только природой вещества, параметрами бумаги и свойствами растворителей и не зависит от концентрации вещества и присутствия других компонентов.
По технике выполнения различают следующие виды хроматографии на бумаге: одномерную, двухмерную и круговую.
Первые два вида могут быть получены в восходящем и нисходящем потоке растворителей (рис. 7.2). Однако двумерная хроматография открывает более широкие возможности в разделении сложных смесей, чем одномерная.
К хроматографической бумаге и растворителям предъявляются определенные требования: бумага должна быть однородной по плотности, химически чистой и инертной по отношению к разделяемым компонентам и подвижному растворителю; объемные соотношения растворителей приведены в таблице 7.2.
При использовании тонкослойной хроматографии (ТСХ)сорбент распределяют тонким слоем (0,25-5,00 мм) на стеклянные или металлические пластинки. Пробу в виде пятна наносят при помощи микропипетки на расстоянии примерно 2,5 см от нижнего края пластинки. Разделение проводят в стеклянной камере, на дно которой налит растворитель слоем 2 см. Пластинку оставляют в камере на определенное время для уравновешивания в закрытом состоянии.
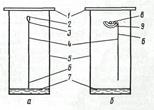
Рисунок 7.2 – Восходящая (а) и нисходящая (б) хроматография на бумаге: 1 – крышка; 2 – держатель; 3 – зажим; 4 – бумага; 5 – стеклянная камера; 6 – место нанесения пробы; 7 – растворитель; 8 – стеклянная палочка; 9 – лоток с растворителем
Таблица 7.2 – Объемные соотношения растворителей, используемые в распределительной хроматографии
| Анализируемые соединения | Растворители |
| Аминокислоты | н-Бутанол–уксусная кислота–вода (40:10:50) н-Бутанол–пиридин–вода (33:33:33) метанол–пиридин–вода (25:12:63) |
| Углеводы | н-Бутанол–пиридин–вода (50:28:22) |
| Хлорофиллы и каротиноиды | 1-Пропанол–петролейный эфир (4:96) хлороформ–петролейный эфир (30:70) |
Многие специальные сорбенты для тонкослойной хроматографии содержат флуоресцирующие красители, поэтому после разделения можно просматривать пластины в ультрафиолетовом свете и при этом отдельные компоненты разделяемой смеси выявляются на них в виде окрашенных пятен.
При тонкослойной хроматографии для разделения веществ применяют ряд растворителей, приведенных в таблице 7.3.
Таблица 7.3 – Системы растворителей для тонкослойной хроматографии
| Анализируемые соединения | Адсорбент | Растворители |
| Аминокислоты | Силикагель | Этанол 96%-ный–вода (70:30) Бутанол–уксусная кислота–вода (80:20:20) |
| Углеводы | Кизельгур | Этилацетат-1–пропанол (65:35) Н-Бутанол–ацетон–фосфатный буфер рН 5 (40:50:10) |
| Нейтральные липиды | Силикагель | Петролейный эфир–диэтиловый эфир–ацетон (90:10:1) |
| Фосфолипиды | Силикагель | Хлороформ–метанол–вода (65:25:10) |
| Каротиноиды | Кизельгур | Петролейный эфир-1–пропанол (99:1) |
Эффективность разделения можно повысить с помощью двухмерной хроматографии (рис. 7.3).

Рисунок 7.3 – Двухмерная хроматограмма
Метод газожидкостной хроматографии (ГЖХ) основан на распределении анализируемых соединений между жидкой и газовыми фазами. Благодаря высокой чувствительности и быстроте разделения он используется для количественного и качественного анализов. Принципиальная схема газожидкостного хроматографа приведена на рис. 7.4.
Основное преимущество данного вида хроматографии перед другими методами заключается в том, что благодаря большой скорости десорбции разделяемых компонентов в газовой среде можно значительно ускорить продвижение проявителя (газа-носителя) и тем самым ускорить процесс разделения.
Например, анализ пятикомпонентной смеси летучих углеводородов, спиртов, жирных кислот, эфиров и т. д. на газовом хроматографе с высокочувствительным детектором может быть проведен за 5 мин.
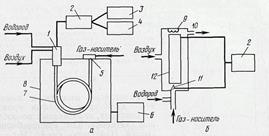
Рисунок 7.4 – Принципиальная схема газожидкостного хроматографа (а) пламенно-ионизационного детектора (б): 1 – детектор; 2 – усилитель; 3 – самописец; 4 – интегратор; 5 – место введения пробы; 6 – устройство, регулирующее температуру термостата; 7 – хроматографическая колонка; 8 – термостат; 9 – запальное устройство; 10 – выходное отверстие; 11 – пламя; 12 – электрод
По полученным хроматографическим кривым можно определить количественный состав анализируемой смеси путем измерения высоты максимумов пиков, а также найти произведение удерживаемого объема разделяемых веществ на высоту пиков.
Площадь пиков в данном случае находят с помощью планиметра, взвешиванием на аналитических весах вырезанного из бумаги пика и сравнением с массой куска той же бумаги известной площади, либо умножением половины высоты пика на его ширину. Удерживаемый объем рассчитывают по оси объемов от момента ввода порции анализируемой пробы до момента достижения максимума пика.
В стандартных условиях (температура, скорость пропускания газа-носителя и т. д.) время прохождения анализируемого соединения через колонку является постоянной величиной и называется временем удерживания (2). При количественном анализе в ГЖК используют внутренний стандарт (1) – соединение, которое по физическим свойствам очень близко к исследуемому, и при хроматографировании движется вдоль колонки.
Отечественная промышленность выпускает хроматографы лабораторного и промышленного типов, обладающие чувствительностью, для некоторых типов 510-14 моль/с.
В основе ионообменной хроматографии многих соединений (аминокислот, органических кислот, сахаров и т. д.) лежит способность к ионизации, обусловливающая суммарный положительный или отрицательный заряд.
Разделение веществ с помощью этого вида хроматографии проводят на колонках, заполненных ионообменной (катионо- или анионообменной) смолой. Набухшую смолу помещают в колонку (рис. 7.5) и подвергают регенерации, пропуская через нее раствор НС1 молярной концентрацией 1 моль/дм3 (для катионообменной) или NaOH той же концентрации (для анионообменной). Затем колонку промывают дистиллированной водой до полного удаления регенерирующего вещества, после чего она готова к хроматографированию. Этот принцип используется во всех промышленных приборах – автоматических аминокислотных анализаторах.
Для разделения ионообменной хроматографией высокомолекулярных соединений (белков, нуклеотидов и др.) в качестве фильтра широко применяется модифицированная целлюлоза.
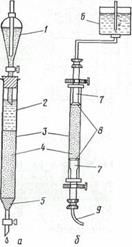
Рисунок 7.5 – Хроматографическая колонка упрощенного (а) и усовершенствованного (б) вариантов: 1 – резервуар; 2 – элюирующий раствор; 3 – стеклянная колонка; 4 – наполнитель; 5 – стеклянная вата; 6 – осуд Мариотта с элюирующим раствором; 7 – регулирующий поршень; 8 – сетка из нейлона; 9 – капиллярный шланг, соединенный с регистрирующим устройством и (или) коллектором фракций
7.4 Проникающая и аффинная хроматография
Метод проникающей хроматографии заключается в разделении молекул по размерам при пропускании через плотное молекулярное сито.
Разделение веществ при помощи гелей, основанное на том же принципе, называется гель-фильтрацией (1).
В качестве молекулярного сита при проникающей хроматографии используют гели с поперечными сшивками (сефадексы) агарозные гели (сефароза, биогель-А), полиакриламидный гель (биогель-Р) и полистиролы (биобидз-S), а также пористые стеклянные шарики (биоглас) и пористый кварц (поросил). Изменяя число поперечных сшивок, удается получать несколько типов сефадексов, различающихся степенью пористости частиц, что позволяет успешно применять их для разделения веществ с различными размерами молекул.
При проникающей хроматографии также пользуются колонками. В последнее время для разделения аминокислот, углеводов, стероидов и липофильных соединений применяют тонкослойную гель-филътрацию на пластинках.
В основе метода аффинной хроматографии лежит уникальное свойство макромолекул – биологическая специфичность, что позволяет при разделении получать вещества высокой степени чистоты. Поэтому аффинная хроматография успешно применяется для очистки белков, витаминов, ферментов и других высокомолекулярных соединений.
Для разделения веществ методом аффинной хроматографии необходимо точно знать кинетические свойства исследуемых соединений, например ферментов.
При очистке всех видов макромолекул методом аффинной хроматографии наблюдается следующее:
М+Л (К+1)/(К-10)→МЛ. (7.2)
Его эффективность (а, следовательно, и очистки) зависит от природы образующегося комплекса МЛ (Л – лиганд для матрицы).
Чтобы правильно выбрать лиганд для этого процесса, необходимо знать свойства подлежащих очистке макромолекул. Лиганд должен содержать химическую группу, которая не участвует в связывании лиганда с макромолекулой, но посредством которой идет его сшивание с матрицей. Чтобы в процессе сшивания не нарушалась способность к связыванию, целесообразно использовать специальные удлиняющие «мостики» (чаще всего это диамины типа NH2(CH2)х–NH2, где Х=2-6).
Колонка для аффинной хроматографии заполняется связанной с лигандом матрицей и уравновешивается буферным раствором, который используется для растворения исследуемого вещества.
Идеальная нерастворимая матрица для аффинной хроматографии должна содержать большое число химических групп, способных ковалентно связываться с лигандом, не разрушаться при связывании и последующей элюации макромолекул, обеспечивать быстрое протекание растворителя. Обычно в качестве матрицы применяют агарозу, синтетические полиакриламидные гели, полистирольные смолы и пористые стеклянные шарики.
1. На чем основан хроматографический метод анализа?
2. Виды и классификация хроматографии.
3. Каковы этапы адсорбционного хроматографического разделения на колонке?
4. Какие адсорбенты применяются в колоночной хроматографии?
5. Виды распределительной хроматографии.
6. Какие растворители и их смеси применяются при распределительной и тонкослойной хроматографии?
7. Каков принцип работы газожидкостного хроматографа пламенно-ионизационного детектора?
8. В чем особенность колоночного ионообменного хроматографического разделения?
9. На чем основан метод проникающей хроматографии?
10. Что такое лиганд, принцип его выбора в аффинной хроматографии?
Список основной литературы
1. Журавская Н.К., Гутник Б.Е., Журавская Н.А. Технохимический контроль производства мяса и мясопродуктов – М.: Колос, 2001. – 476 с.
2. Антипова Л.В., Глотова И.А., Рогов И.А. Методы исследования мяса и мясных продуктов. – М.: Колос, 2001 – 376 с.
3. Марх А.Т., Зыкина Т.Ф., Голубев В.Н. Технохимический контроль консервного производства. – М.: Агропромиздат, 1999. – 304 с.
4. Лурье И.С., Шаров А.И. Технологический контроль сырья в кондитерском производстве. М.: Изд-во «Колос», 2001.352с.
Список дополнительной литературы
1. Химический состав пищевых продуктов. Справочник под ред. И.М. Скурихина. – М.: Агропромиздат, 1987.
2. Коростелев П.П. Лабораторная техника химического анализа. – М.: Химия, 1981.
3. Петров И.К. Технологические измерения и приборы в пищевой промышленности. – М.: Агропромиздат, 1985. – 343 с.
4. Хмельницкий Р.А. Современные методы исследования агрономических объектов. – М.: Высшая школа, 1981. – 256 с.
Дата публикования: 2014-11-18; Прочитано: 856 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
