 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Азот( N2) и соединения азота
|
|
Сам азот — газ малореакционноспособный из-за прочной тройной связи в молекуле. Будучи относительно тяжелым, нерастворимым в воде и химически инертным, этот газ практически не уходит из атмосферы. После инертных газов у него самое большое время пребывания в атмосфере — 106 лет.
Биогеохимическая роль азота двойственна. Во-первых, он разбавляет крайне реакционноспособный кислород — иначе любая растительность активно горела бы. Во-вторых, того его количества, что вступает в химические реакции, достаточно, чтобы обеспечить всю биосферу необходимыми ей соединениями азота.
Азот вступает в реакции либо под действием нитрифицирующих бактерий (восстановление его до солей аммония), либо при очень высокой температуре (окисление до оксида азота (II)). В атмосфере такая температура достигается в грозовых разрядах, в техносфере — в карбюраторных двигателях внутреннего сгорания (системы Отто) и реактивных двигателях.
Образующийся NO, быстро окисляется кислородом воздуха, а получившийся NO2 в присутствии кислорода реагирует с водой, находящейся в виде капелек в облаках. Последнюю реакцию можно записать в виде уравнения:
4NO2 + 2Н2О + О2 = 4HNO3.
На самом деле эта реакция протекает гораздо сложнее (концентрация NO2 в воздухе даже при очень сильной грозе мала, и вероятность встречи четырех молекул — тоже очень мала). Из-за высокой реакционной способности оксидов азота их время пребывания в атмосфере составляет всего около 4 суток.
Азотная кислота вымывается из атмосферы дождями, попадает на землю, нейтрализуется основаниями, которые присутствуют в почве, и образующиеся нитраты усваиваются растениями.
Кислород (О2)
Кислород необходим почти всем живым организмам, поскольку является окислителем органических веществ. Соответствующие реакции окисления служат организмам источниками энергии. Существуют процессы, в которых организм получает энергию без использования кислорода (так называемое анаэробное дыхание), однако эти процессы менее энергетически выгодны.
Если описывать молекулу О2 методом молекулярных орбиталей, то окажется, что на разрыхляющих орбиталях молекулы кислорода находится два неспаренных электрона, то есть молекула кислорода может быть представлена как бирадикал:
О. –— О.
Поэтому она очень реакционноспособна. В частности, в газовой фазе кислород медленно присоединяется к двойным углерод-углеродным связям с последующим их разрывом:
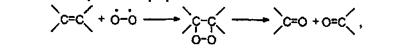
что приводит к окислению этилена и паров терпенов, находящихся в атмосфере. Кислород также присоединяется к радикалам, образующимся в результате некоторых процессов в атмосфере, образуя гидроперекиси:
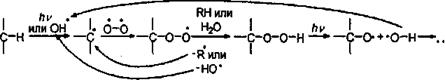
которые окисляют органические вещества в воздухе. Реакция имеет цепной характер, причем в результате может образоваться активнейший гидроксил-радикал, способствующий дальнейшему окислению органических веществ.
В присутствии влаги кислород также может реагировать с минералами, содержащими двухвалентное железо (в частности, с оливином):
2Fe2SiO4 + О2 = 2Fe2O3 + 2SiO2
Долгое время в истории Земли этот процесс препятствовал накоплению кислорода в атмосфере, однако к настоящему времени минералов, содержащих доступное для кислорода двухвалентное железо, на поверхности Земли практически не осталось, и процесс перестал играть существенную роль в глобальном круговороте кислорода, хотя локально вполне может влиять на концентрацию кислорода.
Итак, живые фотосинтезирующие организмы — единственный источник и основной сток кислорода. До начала промышленной революции (середина XVIII века) атмосфера была практически стационарна по кислороду (сколько кислорода поглощалось в результате дыхания и разложения органических остатков, а также лесных пожаров, столько же выделялось в результате фотосинтеза). Относительно небольшое накопление органического вещества в болотах постоянно увеличивали и увеличивают концентрацию кислорода, но в настоящее время этот поток незначителен.
Однако последние два века человек начал извлекать органическое вещество из «могилы» в виде ископаемого топлива и сжигать его, что приводит к затратам кислорода. В результате стационарность глобальной экосистемы по кислороду сильно нарушилась (скорость образования кислорода в атмосфере —- 1,5-109 т/год, а расходования — 2,2-1010 т/год). Однако это нарушение все равно незначительно по сравнению с общей массой кислорода, то есть заметного изменения концентрации кислорода до сих пор не произошло. Более того, имеющихся запасов ископаемого топлива недостаточно, чтобы всерьез снизить его концентрацию (чего нельзя сказать о повышении концентрации СО2).
Углекислый газ (СО2)
Как и в случае кислорода, и источником, и стоком углекислого газа являются живые организмы. Углекислый газ необходим растениям для фотосинтеза сложных органических веществ, из которых они впоследствии черпают энергию и материал для постройки собственного тела. В настоящий момент углекислый газ дефицитный ресурс, в результате чего время его пребывания в атмосфере невелико — 4 года (сравните с 5000 лет для кислорода).
До начала промышленной революции атмосфера была почти стационарна по углекислому газу (не считая незначительного выведения в виде органических веществ, например, торфа). В глобальной экосистеме поддерживалось постоянство концентрации СО2 в атмосфере, в течение многих миллионов лет.
Однако с началом сжигания ископаемого топлива в атмосферу стали поступать новые порции углекислого газа. К этому добавился углекислый газ, образующийся при усилении разрушения гумуса из-за распашки почв. Одновременное разрушение почв и сведение лесов привело к тому, что увеличение интенсивности фотосинтеза не поспевает за ростом концентрации углекислого газа, и разрушение гумусового слоя привело к росту содержания углекислого газа в атмосфере.. В результате содержание углекислого газа в атмосфере примерно с 1850 года неуклонно растет:

Дата публикования: 2014-11-18; Прочитано: 536 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
