 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Оптические свойства коллоидных систем
|
|
Особые оптические свойства коллоидных растворов обусловлены их главными особенностями: дисперсностью и гетерогенностью. На оптические свойства дисперсных систем в значительной степени влияют размер и форма частиц. Прохождение света через коллоидный раствор сопровождается такими явлениями, как поглощение, отражение, преломление и рассеяние света. Преобладание какого-либо из этих явлений определяется соотношением между размером частиц дисперсной фазы и длиной волны падающего света. В грубодисперсных системах в основном наблюдается отражение света от поверхности частиц. В коллоидных растворах размеры частиц сравнимы с длиной волны видимого света, что предопределяет рассеяние света за счёт дифракции световых волн.
Светорассеяние в коллоидных растворах проявляется в виде опалесценции – матового свечения (обычно голубоватых оттенков), которое хорошо заметно на тёмном фоне при боковом освещении золя. Причиной опалесценции является рассеяние света на коллоидных частицах за счёт дифракции. С опалесценцией связано характерное для коллоидных систем явление – эффект Тиндаля: при пропускании пучка света через коллоидный раствор с направлений, перпендикулярных лучу, наблюдается образование в растворе светящегося конуса.
Процесс дифракционного светорассеяния на частицах, размер которых значительно меньше длины волны описывается уравнением Рэлея, связывающим интенсивность рассеянного единицей объёма света I с числом частиц в единице объёма ν, объёмом частицы V, длиной волны λ и амплитудой А падающего излучения и показателями преломления дисперсной фазы и дисперсионной среды n1 и n2 соответственно:
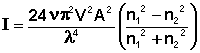 (IV.24)
(IV.24)
Из уравнения (IV.18) видно, что, чем меньше длина волны падающего излучения, тем больше будет рассеяние. Следовательно, если на частицу падает белый свет, наибольшее рассеивание рассеяние будут испытывать синие и фиолетовые компоненты. Поэтому в проходящем свете коллоидный раствор будет окрашен в красноватый цвет, а в боковом, отраженном – в голубой.
На сравнении интенсивности светорассеяния золей, один из которых имеет известную концентрацию (степень дисперсности), основан метод определения концентрации либо степени дисперсности золя, называемый нефелометрией. На использовании эффекта Тиндаля основывается ультрамикроскоп – прибор, позволяющий наблюдать коллоидные частицы размером более 3 нанометров в рассеянном свете (в обычном микроскопе можно наблюдать частицы с радиусом не менее 200 нм из-за ограничений, связанных с разрешающей способностью оптики).
Варианты заданий соответствуют порядковому номеру студента в журнале группы
Вариант 1
1. Агрегатные состояния вещества: газообразное, жидкое, твердое, плазма. Краткая характеристика.
2. Буферные растворы, в том числе тканевых жидкостей, крови, молока. Их значение.
Определите концентрацию ионов гидроксида, величину рН и среду раствора, если концентрация ионов водорода равна: а) 10–4 моль/л; б) 10–8 моль/л.
3. Пены: понятие, строение и устойчивость. Роль пенообразователей. Получение и разрушение пен. Твердые пены.
Вариант 2
1. Газообразное состояние. Идеальный газ. Законы идеальных газов. Нормальные условия.
Реальные газы. Физический смысл постоянных в уравнении состояния реального газа.
В баллоне емкостью 12 л при температуре 0° С находится 100 г кислорода. Определить давление в баллоне.
2. Адсорбтив. Адсорбент. Назовите вещества, наиболее часто употребляемые в качестве адсорбента. Удельная поверхность адсорбента. Единицы ее измерения.
3. Порошки. Текучесть порошков. Пищевые продукты, имеющие структуру порошков.
Вариант 3
1. Жидкое состояние вещества. Ближний порядок расположения частиц. Поверхностное натяжение и факторы, определяющие поверхностное натяжение. Методы определения поверхностного натяжения.
Вычислите поверхностное натяжение раствора этилового спирта, если при выпускании из сталагмометра масса 57 капель составила при 24Со 10–3 кг, а масса 29 капель воды составила 4,6386.
2. Гетерогенный катализ, его стадии. Применение катализа, его стадии. Применение катализа. Ингибиторы. Антиоксиданты.
3. Синерезис студней: понятие, структурные изменения. Факторы, оказывающие влияние на скорость синерезиса. Практическое значение синерезиса.
Вариант 4
1.Вязкость жидкостей. Факторы, определяющие вязкость жидкостей. Измерение вязкости жидкостей. Относительная вязкость.
Вычислите динамическую вязкость бензола при 20 С, если он протекает через вискозиметр за 91,5 с. Время прохождения такого же объема воды при той же температуре – 2 мин.
2.Особенности ферментативного катализа. Кинетика ферментативных реакций.
Применение ферментативного катализа в пищевой промышленности.
3. Оптические свойства коллоидных систем. Эффект Тиндаля. Опалесценция.
Вариант 5
1. Твердое состояние вещества. Кристаллические и амфотерные твердые тела. Анизотропия. Типы кристаллических решеток.
2. Растворы электролитов. Изотонический коэффициент.
Вычислить ионную силу раствора и активность ионов в растворе, содержащем 0,01М сульфата магния и 0,01 М хлорида магния.
3. Влияние размеров пор адсорбента на его адсорбционную способность. Обращение правила Дюкло-Траубе при адсорбции на неполярных адсорбентах органических веществ из водных растворов. Какие адсорбенты (полярные или неполярные) следует выбирать для получения абсолютного спирта, т.е. для извлечения из спирта следов воды.
Вариант 6
1. Термодинамика. Термодинамические системы. Классификация систем.
Параметры термодинамической системы. Термодинамические процессы.
2.Понижение температуры замерзания растворов. Криоскопическая константа. Криоскопия. Антифриз.
Температура кипения водного раствора сахарозы равно 101,4 0 С. Вычислить моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор?
3. Примеры адсорбционных процессов в технологии пищевых производств. Хроматография, ее применение в технохимическом контроле пищевых производств.
Вариант 7.
1. Понятие о внутренней энергии, теплоте и работе. Математическое выражение первого закона термодинамики.
Первый закон термодинамики для изохорного и изобарного процесса. Понятие об энтальпии.
2. Замерзание и кипение растворов. Второй закон Рауля.
В 100 г бензола растворено 2,56 г нафталина С10Н8, рассчитайте понижение температуры замерзания этого раствора, если криоскопическая константа бензола равна 5,2
3. Молекулярно-кинетические свойства коллоидных систем. Диффузия и осмос в золях. Седиментация.
Вариант 8.
1. Термохимия. Закон Гесса и следствия из него.. Тепловой эффект химической реакции, теплота образования химического вещества. Теплота сгорания химического вещества.
Вычислите, сколько тепла выделится при сгорании 100 литров (н.у.) углеводородов. Реакция горения протекает по уравнению:
С2Н6 (г) + 3,5 О2 (г) → 2СО2 (г) + 2Н2О (ж) + 1559,9 кДж
2. Дисперсные системы. Классификация дисперсных систем по разным признакам.
3. Аэрозоли. Классификация аэрозолей по разным признакам. Взрывоопасность. Методы разрушения аэрозолей. Применение аэрозолей.
Вариант 9.
1. Энтропия. Направление химических реакций. Второе начало термодинамики.
В каком направлении сместиться равновесие при повышении давления в системах:
а) 2 NО (г) + О2 (г)  2 NО2 (г);
2 NО2 (г);
б) 4НСI (г) + О2  2Н2О (ж) + 2СI2 (г);
2Н2О (ж) + 2СI2 (г);
в) 2SО3 (г)  2SО2 (г) + О2 (г)
2SО2 (г) + О2 (г)
2. Законы Коновалова. Азеотропные смеси. Перегонка. Фракционная перегонка. Ректификация.
3. Виды устойчивости коллоидных систем: агрегативная, седиментационная (кинетическая). Факторы, обеспечивающие кинетическую устойчивость золей.
Вариант 10
1. Термодинамические потенциалы, определяющие самопроизвольное протекание реакций. Энергия Гиббса.
Рассчитайте изменение энергии Гиббса при 250 С процесса взаимодействия гидрида калия с водой, используя стандартные значения энтальпии и энтропии реагирующих веществ.
2. Правило уравнения поверхностей Ребиндера. Какие адсорбенты (полярные или неполярные) следует выбирать для очистки питьевой воды от фенола?
3.Общая характеристика микрогетерогенных систем.
Вариант 11.
1. Поверхностное натяжение. Методы определения поверхностного натяжения. Поверхностно-активные вещества. Их роль в технологии продуктов общественного питания: эмульгирование, пенообразование.
2. Строение двойного электрического слоя. Причины возникновения Д.Э.С. Поверхностный и электрокинетический потенциалы; изменение потенциала с изменением расстояния от поверхности.
3. Влияние концентрации на скорость химической реакции. Закон действующих масс. Физический смысл константы. Скорость реакции.
Взаимодействие между оксидом углерода и хлором идет по уравнению СО + СI2 → СОСI2. Концентрация оксида углерода 0,3 моль/л, а хлора 0,2 моль/л. Как изменится скорость реакции, если увеличить концентрацию хлора до 0,6 моль/л, а концентрацию оксида углерода до 1,2 моль/л
Вариант 12
1. Компонент, фаза, число термодинамических степеней свободы системы. Правило фаз Гиббса.
Однокомпонентные системы. Системы гомогенные и гетерогенные. Диаграмма состояния воды.
2. Применение адсорбции в технологических процессах осветления мясных и рыбных бульонов, фруктово-ягодных сиропов, при использовании пищевых красителей, при производстве сахара, глюкозы, вин, ионитного молока, очистки питьевой воды.
3. Основные понятия химической кинетики. Кинетические уравнения. Кинетические кривые.
Вариант 13.
1. Теплота растворения: молярная. Удельная. Механизм растворения твердых веществ.
Выделение теплоты при растворении некоторых твердых веществ. Сольватная теория Д.И. Менделеева.
При растворении 8,00 г хлорида аммония в 292 мл воды температура раствора понизилась на 2,00 0С. Вычислите теплоту растворения соли в воде, принимая удельную теплоемкость полученного раствора равной теплоемкости воды 4,187 Дж/(г ∙ К).
2. Применение электрофореза и электроосмоса в пищевых производствах.
3.Структурно-механические свойства гетерогенных дисперсных систем. Свободно-дисперсные и связно-дисперсные системы, их различия.
Вариант 14
1. Растворимость газов в жидкостях. Закон Генри. Факторы, определяющие растворимость газов в жидкостях.
Растворимость газов в жидкостях, зависимость от температуры и давления. Использование теории растворов при приготовлении и хранении газированных напитков.
2. Электрохимия. Электропроводность растворов электролитов (сильных и слабых электролитов).
3. Порядок и молекулярность реакции. Реакции I, II порядков.
2NН3 + 3Cl2 = N2 + 6HCl
Как изменится скорость прямой реакции, протекающей в газовой фазе, если концентрацию аммиака увеличить в 4 раза?
Вариант 15
1. Растворимость жидкостей в жидкостях. Закон распределения. Экстракция.
2.Уравнение Аррениуса. Физический смысл энергии активации. Энергетическая диаграмма химической реакции.
Исходные концентрации оксида азота (II) и хлора в системе:
2NO + Cl2 = 2NOCl
составляют соответственно 0,50 моль/л и 0,20 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 25,0 % оксида азота. Как изменилась скорость прямой реакции при наступлении равновесия по сравнению с ее начальной скоростью?
3. Очистка коллоидных систем. Диализ. Ультрафильтрация. Применение этих процессов в пищевой промышленности.
Вариант 16.
1. Коллигативные свойства растворов. Диффузия. Осмос. Осмотическое давление растворов.
Определите осмотическое давление раствора,содержащего 12 г мочевины СО(NH2)2 в 2 л раствора при 200
2. Поверхностная активность молекул ПАВ. Механизм действия ПАВ. Правило Дюкло-Траубе.
3. Пасты, распространение в продовольственных и непродовольственных товарах.
Вариант 17.
1. Классификация гетерогенных дисперсных систем по: агрегатному состоянию фазы и среды, размеру частиц, взаимодействию между фазой и жидкой дисперсионной средой.
2. Если целый маринованный помидор поместить в дистиллированную воду, то он через некоторое время лопается. Почему? Плазмолиз. Тургор. Биологическое значение осмоса.
3. Гальванические элементы как химические источники получения электрической энергии.
Вариант 18.
1. Давление насыщенного пара над раствором. Закон Рауля. Идеальные растворы. Отклонения от закона Рауля.
При 25°С давления насыщенного пара воды составляет 3,166 кПа (23,75 мм.рт.ст). Найти при той же температуре давление насыщенного пара над 5% водным раствором карбамида (мочевины) CO(NH2)2.
2. Строение мицеллы золя на примере. Адсорбционный и диффузионный слои ионов. Потенциалопределяющие ионы и противоионы. Падение потенциала в Д.Э.С. мицеллы.
3. Суспензии, распространение в продовольственных и непродовольственных товарах.
Вариант 19
1. Зависимость скорости реакции от температуры. Правило Вант-Гоффа.
При 200С реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция: а) при 00С; б) при 500С? Температурный коэффициент скорости реакции равен 2.
2. Готовность хлебобулочных изделий можно определить по температуре центра мякиша. Для хлеба она составляет 96-970С, а для сдобных изделий – 102-1030С. Объясните такое различие температур на основе закона Рауля.
3. Коллоидные ПАВ. Строение мицелл коллоидных ПАВ в водных растворах.
Вариант 20
1. Повышение температуры кипения растворов. Эбулиоскопическая константа. Эбулиоскопия.
Сколько граммов глюкозы С6Н12О6 содержится в 100 г воды, если раствор кипит при температуре 1010С? Кэб = 0,52.
2. Катализаторы. Катализ. Виды катализа. Энергетическая диаграмма химической реакции. Механизм гомогенного катализа. Влияние катализатора на энергию активации Еа реакции.
3. Моющее действие коллоидных ПАВ. Критическая концентрация мицеллообразования (К.К.М.). Солюбилизация.
Вариант 21.
1. Гетерогенный катализ, его стадии. Применение катализа, его стадии. Применение катализа. Ингибиторы. Антиоксиданты.
2. Коагуляция золей. Факторы, вызывающие коагуляцию. Порог коагуляции. Коагулирующая способность ионов.
Вычислите порог коагуляции раствора сульфата натрия, если добавление 0,003 л 0,1н раствора этой соли вызывает коагуляцию 0,015 л золя.
3. Высокомолекулярные электролиты в пищевой промышленности.
Приведите примеры природных синтетических высокомолекулярных соединений.
Вариант 22.
1. Методы получения коллоидных систем: диспергирование, конденсация.
Вычислите удельную поверхность частиц золя золота, полученного в результате дробления 0,5 г золота на частицы шарообразной формы диаметром 7,0*10-9 м. Плотность золота 19 320кг/м3.
2.Определение степени диссоциации методом измерения электропроводности. Кондуктометрия.
3.Эмульсии. Классификация эмульсий: а) по концентрации частиц дисперсионной фазы; б) по полярности дисперсионной фазы и дисперсионной среды.
Вариант 24
1. Строение двойного электрического слоя. Причины возникновения Д.Э.С. Поверхностный и электрокинетический потенциалы; изменение потенциала с изменением расстояния от поверхности.
Коагуляция золя иодида серебра,частицы которого заряжены отрицательно, вызывается катионами добавленного электролита. Порог коагуляции LiNO3 для этого золя равен 165 ммоль/л. Вычислите порог коагуляции нитрата алюминия для этого золя.
2. Применение адсорбции в пищевой промышленности
3.Фазовая диаграмма для воды. Расчет числа степеней свободы при различных условиях.
Вариант 25
1. Изобразите адсорбционно-сольватный слой, который образуют на поверхности капельки ПАВ: а) в случае прямой эмульсии; б) в случае обратной эмульсии. Пищевые продукты – эмульсии.
2. Строение мицеллы. Электрокинетический и термодинамический потенциалы.
При пропускании избытка сероводорода в раствор соли мышьякa(III) AsCl3 получили золь сульфида мышьяка. Учитывая условия образования, напишите формулу мицеллы золя и определите знак его заряда.
3. Энергия Гиббса (G) и свободная энергия Гельмгольца (F)
Изменение изобарно-изотермического потенциала (∆G) и изохорно-изотермического потенциала (∆F) для обратимых и необратимых самопроизвольных процессов.
Вариант 26
1. Что называют электрокинетическим потенциалом? Как определить дзетапотенциал частиц золя экспериментально? Факторы, влияющие на электрокинетический потенциал.
Какой объем 0,002 н раствора хлорида бария надо добавить к 0,03 л 0,006 н сульфата алюминия, чтобы получить положительно заряженные частицы золя сульфата бария. Напишите формулу мицеллы золя.
2. Химическое равновесие и его основные условия. Константа химического равновесия.
3. Высокомолекулярные соединения (ВМС). Классификация ВМС.
Растворы ВМС. Термодинамика их образования.
Вариант 27.
1. Электрокинетические явления. Электрофорез. Электроосмос. Причины электрокинетических явлений; их применение.
2.Коллигативные свойства растворов.
Давление насыщенного пара над раствором. Закон Рауля. Идеальные растворы. Отклонения от закона Рауля.
Зная, что давление пара воды при температуре 25° С равно 3168 Па, определить давление 8%-ного водного раствора глюкозы С6Н12О6.
3. Пены. Пищевые продукты, имеющие структуру пены. Стабилизаторы пен. Пеногасители.
Вариант 28
1. Свободно- и связнодисперсные системы. Механизм процесса гелеобразования. Тиксотропия и синерезис в пищевых продуктах. Пептизация.
2. Степень диссоциации, ее зависимость от температуры и концентрации раствора. Константа диссоциации, независимость этой величины от концентрации раствора. Сильные и слабые электролиты.
Определите концентрацию ионов гидроксида, величину pH и среду раствора, если концентрация ионов водорода равна:
а) 10–9 моль/л; б) 10–2 моль/л.
3. Мицеллообразование в пищевых системах
Вариант 29
1. Набухание полимеров. Стадии набухания. Растворы В.М.С. Сходство и различие растворов В.М.С. с коллоидными и истинными растворами, коацервация, студни.
2. Методы хроматографии. Ионно-обменная адсорбция; применения ее в
пищевой промышленности.
3. Химическое равновесие. Влияние различных факторов на его смещение. Реакция протекает по уравнению:
2SО2 (г) + О2 (г)  2SО3 (ж), ∆Н0 = -284,2 кДж
2SО3 (ж), ∆Н0 = -284,2 кДж
Изменение каких параметров можно добиться смещения равновесия в сторону образования оксида серы (VI)?
Вариант 30.
1.Высокомолекулярные соединения (ВМС). Классификация ВМС.
Растворы ВМС. Набухание ВМС. Ограниченное и неограниченное набухание. Кинетика набухания. Причины ограниченного набухания.
2. Основные термодинамические характеристики системы.
Вычислите, сколько тепла выделится при сгорании 100 литров (н.у.) углеводородов. Реакция горения протекает по уравнению:
С2Н2 (г) + 2,5 О2 (г) → 2СО2 (г) + Н2О (ж) + 1299,63 кДж
3. Дисперсная фаза и дисперсионная среда. Степень дисперсности и удельная поверхность.
Экзаменационные вопросы по курсу Физическая и коллоидная химия
1. Агрегатные состояния вещества: газообразное, жидкое, твердое, плазма. Краткая характеристика.
2. Газообразное состояние. Идеальный газ. Законы идеальных газов. Нормальные условия.
3. Реальные газы. Физический смысл постоянных в уравнении состояния реального газа.
4. Жидкое состояние вещества. Ближний порядок расположения частиц. Поверхностное натяжение и факторы, определяющие поверхностное натяжение. Измерение поверхностного натяжения.
5. Вязкость жидкостей. Факторы, определяющие вязкость жидкостей. Измерение вязкости жидкостей. Относительная вязкость.
6. Твердое состояние вещества. Кристаллические и амфотерные твердые тела. Анизотропия. Типы кристаллических решеток.
7. Химическая термодинамика. Основные понятия (система, фаза). Термодинамические параметры и функции состояния.
8.Первый закон термодинамики и его различные формулировки. Применение закона к изотермическому, изобарному, изохорному процессам.
9. Второй закон термодинамики и его различные формулировки.
4.Термохимия. Закон Гесса. Стандартные условия. Следствия из закона Гесса.
10.Теплота образования и теплота сгорания химических веществ. Расчет теплового эффекта реакции.
11.Энтропия и ее изменения в обратимых и необратимых процессах.
12. Энергия Гиббса (G) и свободная энергия Гельмгольца (F)
Изменение изобарно-изотермического потенциала (∆G) и изохорно-изотермического потенциала (∆F) для обратимых и необратимых самопроизвольных процессов.
13. Химическая кинетика. Скорость реакции. Константа скорости. Закон действующих масс.
14.Зависимость константы скорости реакции от температуры. Уравнение Аррениуса, его анализ. Изменение энергии системы в ходе реакции. Энергия активации.
15. Катализ. Общий механизм действия катализаторов. Ферментативный катализ.
16. Химическое равновесие и его основные условия. Константа химического равновесия.
17.Зависимость константы химического равновесия от температуры. Принцип Ле-Шателье.
18.Фазовые (гетерогенные) равновесия. Условия фазовых равновесий.
Закон равновесия фаз – правило фаз Гиббса. Применение для различных систем.
19.Фазовая диаграмма для воды. Расчет числа степеней свободы при различных условиях.
20.Растворы. Идеальные и реальные растворы.
21. Коллигативные свойства растворов.
22.Закон Рауля для растворов (для электролитов и неэлектролитов). Следствия закона Рауля.
23. Диффузия и осмос.
24.Электрохимия. Электропроводность растворов электролитов (сильных и слабых электролитов). Удельная, эквивалентная электропроводность. 25.Определение степени диссоциации методом измерения электропроводности. Кондуктометрия.
26. Электродные процессы. Обратимые и необратимые электроды.
27. Гальванические элементы. Электродвижущая сила (ЭДС). Измерение электродвижущей силы.
28. Коллоидные системы, их определение. Особенности коллоидного состояния вещества. Дисперсная фаза и дисперсионная среда. Степень дисперсности и удельная поверхность.
29.Классификация гетерогенных дисперсных систем по: агрегатному состоянию фазы и среды, размеру частиц, взаимодействию между фазой и жидкой дисперсионной средой.
30.Методы получения коллоидных систем.
31. Строение мицеллы.
32.Оптические свойства коллоидных систем. Рассеяние света.
33. Абсорбция света (поглощение света). Оптическая плотность. Применение к коллоидным системам.
34. Молекулярно-кинетические свойства коллоидных систем.
35.Поверхностные явления. Сорбция. Адсорбция и десорбция. Адсорбент, адсортив. Физическая и химическая адсорбция, их особенности.
36.Адсорбция на границе твердое тело-газ. Основные положения теории мономолекулярной адсорбции (теории Лэнгмюра).
37. Адсорбция на границе твердое тело-раствор. Избирательная адсорбция ионов. Обменная адсорбция. Иониты.
38.Смачивание. Краевой угол. Флотация.
39. Адсорбция на границе раствор-газ. Поверхностное натяжение жидкостей и методы его определения.
40.Изотермы поверхностного натяжения водных растворов различных веществ. Поверхностно-активные вещества (ПАВ), поверхностно-инактивные вещества и поверхностно-неактивные вещества.
41. Строение молекул ПАВ, их дифильность, гидрофильные и липофильные (гидрофобные) функциональные группы.
42.Поверхностная активность. Правило Траубе для ПАВ.
43. Коллоидные (мицеллярные) ПАВ, их свойства. Равновесие: молекулярный, ионный (истинный) раствор – коллоидная система (мицеллярный раствор).
44. Критическая концентрация мицеллообразования (ККМ) и влияние различных факторов на величину ККМ.
45. Типы коллоидных ПАВ (анионные, катионные, неионогенные, амфотерные)
46.Двойной электрический слой (ДЭС) на границе фаз и строении мицеллы. Термодинамический, электрокинетический потенциалы в ДЭС, толщина ДЭС.
47. Устойчивость и коагуляция коллоидных систем. Агрегативная и кинетическая (седиментационная) устойчивость коллоидных систем.
48.Влияние электролитов на электростатическое отталкивание коллоидных частиц. Правила коагуляции электролитами.
49. Высокомолекулярные соединения (ВМС). Классификация ВМС.
Растворы ВМС. Термодинамика их образования.
50. Набухание ВМС. Ограниченное и неограниченное набухание. Кинетика набухания. Причины ограниченного набухания.
51.Высокомолекулярные электролиты.
52. Растворы ВМС и коллоидные системы. Принципиальное различие и сходство этих систем.
53. Структурно-механические свойства гетерогенных дисперсных систем. Свободно-дисперсные и связно-дисперсные системы, их различия. Золь, гель, структурированные коллоидные системы.
54.Тиксотропия. Синерезис. Области возникновения и применения этих структур.
55. Влияние структурно-механических свойств гетерогенных дисперсных систем на качество продовольственных и непродовольственных товаров.
56. Грубодисперсные гетерогенные системы.
57. Эмульсии, их классификация, стабилизация, получение.
58. Суспензии и пасты, распространение в продовольственных и непродовольственных товарах.
59. Аэрозоли, распространение в продовольственных и непродовольственных товарах.
60. Пены, распространение в продовольственных и непродовольственных товарах.
Дата публикования: 2014-11-18; Прочитано: 3324 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
