 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Решение. В данной работе объектом исследования является система химически взаимодействующих реальных газов
|
|
В данной работе объектом исследования является система химически взаимодействующих реальных газов. Реальная система исследуются с использованием стехиометрической и термодинамической моделей реактора.
Балансный состав реакционной смеси газов моделируется стехиометрическим реактором. При моделировании задаются начальные концентрации исходных веществ и степень превращения целевого компонента. Равновесная степень превращения целевого компонента моделируется термодинамическим реактором.
При заданных соотношениях начальных концентраций реагентов водород - в недостатке  . Выбираем целевым компонентом Н2.
. Выбираем целевым компонентом Н2.
Условия проведения химического превращения задаются температурой и давлением процесса. Как объем перерабатываемых веществ, так температура и давление процесса – это традиционные технологические параметры для любого процесса химической технологии.
Проведем анализ системы при с0Н2 = 53%, шаг Т = 50 °С, Р = 10, 100, 200, 400, 600 атм.


При изменении с0 значения коэффициента летучести газовой смеси Ке и константы химического равновесия Кр не изменяются, т.е. зависят только от технологических параметров Т и Р.

Рис. 1 Зависимость коэффициента летучести от Т и Р
Коэффициент летучести характеризует меру отклонения реального газа от идеального Ке = fi/pi. На графике рис.1 видно, что при Р = 10 атм Ке → 1, т.е. свойства газа приближаются к свойствам идеального. С повышением давления отклонение увеличивается, Ке<<1. Рост температуры увеличивает коэффициент летучести.
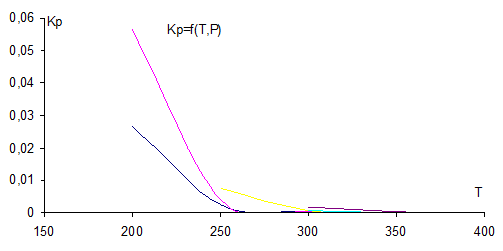
Рис. 2 Зависимость константы химического равновесия от Т и Р
Реакция экзотермическая, по принципу Ле Шателье повышение Т смещает равновесие реакции влево, что подтверждает график рис.2 (константа химического равновесия уменьшается. При повышении давления равновесие сдвигается в направлении образования веществ с меньшим объемом. Так, видно, что при Р = 10 атм кривая более крутая, чем при 100 атм и быстрее стремится к нулю. С повышением Р равновесная кривая смещается вправо, т.е. процесс можно вести при больших Т и с большим выходом продукта.
Анализ зависимости концентрации целевого продукта в равновесной газовой смеси от технологических параметров Спродукт = f (Т, Р) при С0i = const:


Рис. 3.1. Зависимость концентрации продукта в смеси от Т, Р при С0=53 % об.
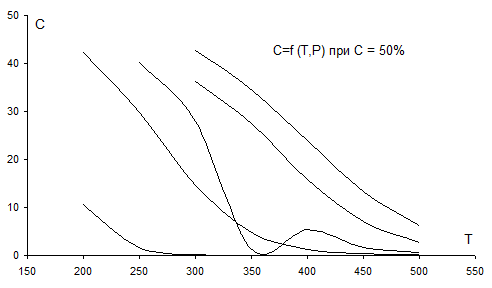
Рис. 3.2. Зависимость концентрации продукта в смеси от Т, Р при С0=50 % об.

Рис. 3.3. Зависимость концентрации продукта в смеси от Т, Р при С0=56 % об.

Рис. 3.4. Зависимость концентрации продукта в смеси от Т, Р при С0=60 % об.

Рис. 3.5. Зависимость концентрации продукта в смеси от Т, Р при С0=65 % об.
На графиках рис. 3.1 - 3.5 видно, что с ростом Т концентрация продукта снижается (то же показал анализ Кр). Кривые при разных давлениях показывают, что повышение давления повышает концентрацию продукта в смеси.
Анализ зависимости теплового эффекта химического превращения от технологических параметров Q = f (Т, Р) при С0i = const


Рис. 4.1. Зависимость теплового эффекта реакции от Т, Р при С0=53 % об.
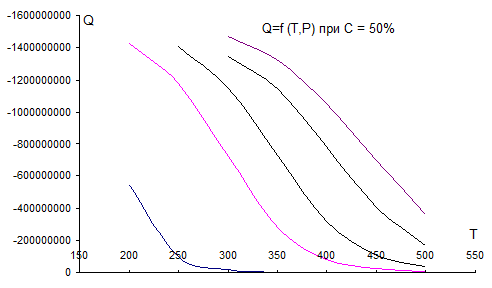
Рис. 4.2. Зависимость теплового эффекта реакции от Т, Р при С0=50 % об.
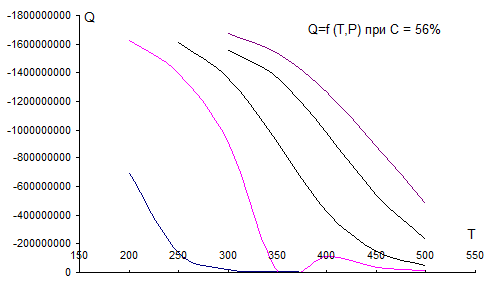
Рис. 4.3. Зависимость теплового эффекта реакции от Т, Р при С0=56 % об.

Рис. 4.4. Зависимость теплового эффекта реакции от Т, Р при С0=60 % об.

Рис. 4.5. Зависимость теплового эффекта реакции от Т, Р при С0=65 % об.
На графиках рис. 4.1 – 4.5 видно, что с увеличением Т тепловой эффект реакции резко снижается (равновесие смещается в сторону эндотермической реакции, влево). Кривые при разных давлениях расположены правее и выше при увеличении Р, т.е. с ростом Р тепловой эффект реакции увеличивается при Т = const.(равновесие смещается вправо).
Проведем анализ зависимости равновесной степени превращения целевого компонента от основных технологических показателей процесса Хр= f (Т, Р, С0i).

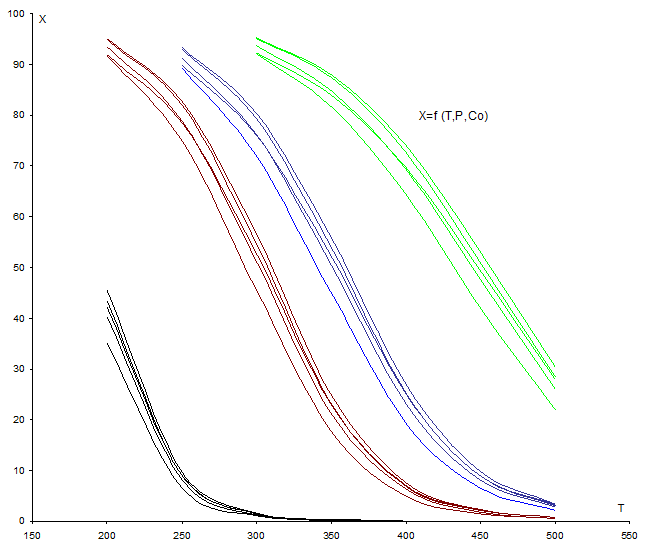
Рис. 5 Зависимость равновесной степени превращения Н2 от Т, Р и С0.
Зависимость Хр= f (Т, Р, С0i) является одной из самых главных в химической технологии, т. к. она устанавливает максимально возможное извлечение целевых продуктов из перерабатываемого сырья. На графике рис. 5 видно, как одновременно влияют Т, Р и С0. Повышение температуры тормозит процесс тем сильнее, чем ниже давление.
Разбавление газовой смеси азотом эквивалентно понижению давления. Так, содержание азота наибольшее в смеси Н2=50 % (об.), СО = 30 % (об.) и составляет 20 % об. Кривая для этой смеси ниже других при Р = const для всех значений общего давления. Наименьшее содержание инерта в смеси Н2 + СО = 60 + 39 % (об.). Кривая для этой смеси выше других при Р = const.
В результате проведения количественного автоматизированного анализа стехиометрических и термодинамических свойств химического реактора синтеза метанола получена количественная зависимость равновесной степени превращения целевого компонента от технологических параметров Хр= f (Т, Р, С0i).
Дата публикования: 2014-11-18; Прочитано: 266 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
