 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Одержання рекомбінантного інсуліну
|
|
Гормон інсуліну має два поліпептидних ланцюги, А та В, завдовжки 20 і 30 амінокислот, відповідно. Послідовність ланцюгів була встановлена у 1955 р. Сенгером. Синтез обох ланцюгів, що включає 170 хімічних реакцій, у 1963 р. було реалізовано в США, ФРН та Китаї. Але перенести такий складний процес у промисловість виявилося неможливим. Одержували інсулін до 1980 р. за рахунок виділення його з підшлункової залози (підшлункова залоза корови важить 200...250 г., а для одержання 100 г кристалічного інсуліну потрібно до 1 кг вихідної сировини). Тому потреби в ньому задовольняли не повністю. Так, у 1979 р. з 6 млн. зареєстрованих хворих на цукровий діабет, інсулін одержували тільки 4 млн. людей. У 1980 р. датською компанією «Новоіндастрі» розроблено метод перетворення інсуліну свині в інсулін людини ферментативним заміщенням залишку аланіну, що є 30-ю амінокислотою в ланцюгу В, на залишок треоніну. У результаті був отриманий однокомпонентний інсулін людини 99% чистоти.
В організмі тварини два поліпептидні ланцюги спочатку є частинами однієї білкової молекули завдовжки 109 амінокислот − це препроінсулін. За синтезу в клітинах підшлункової залози перші 23 амінокислоти є сигналом для проходження молекули крізь мембрану клітини. Ці амінокислоти відщеплюються і утворюється проінсулін завдовжки 86 амінокислот.
У 1980 р. В. Гілберт із колегами виділили мРНК інсуліну з пухлини  -клітин підшлункової залози пацюка (у той час не дозволяли маніпулювати генами людини; рис. 38).
-клітин підшлункової залози пацюка (у той час не дозволяли маніпулювати генами людини; рис. 38).
Отриману ДНК-копію мРНК вмонтували в плазміду рВR 322, у середню частину гена пеніцилінази (фермент у нормі виділяється із клітини), яку транспортували в бактерію. Сконструйована плазміда, як виявилося, містила інформацію про структуру проінсуліну, а не препроінсуліну. За трансляції мРНК у клітинах Е. соli синтезувався гібридний білок, що містить послідовності пеніцилінази й проінсуліну. Гормон із цього білка вищеплювали трипсином. Було доведено, що отриманий таким чином білок впливає на цукровий обмін аналогічно гормону підшлункової залози.
У 1979 р. у США протягом трьох місяців синтезували гени, що кодують А- і В-ланцюги інсуліну; гени зібрали з 18 і 11 олігонуклеотидів, відповідно. Далі гени були вбудовані, як і приодержанні соматостатину, у плазміду наприкінці гена  -галактозидази кишкової палички. У клітинах Е. соli здійснювався синтез проінсуліну, а не тільки його окремих ланцюгів. На виділеній матричній мРНК синтезували ДНК-копію. Синтез проінсуліну має певні переваги, тому що процедури екстракції й очищення гормону мінімальні(рис.39).
-галактозидази кишкової палички. У клітинах Е. соli здійснювався синтез проінсуліну, а не тільки його окремих ланцюгів. На виділеній матричній мРНК синтезували ДНК-копію. Синтез проінсуліну має певні переваги, тому що процедури екстракції й очищення гормону мінімальні(рис.39).
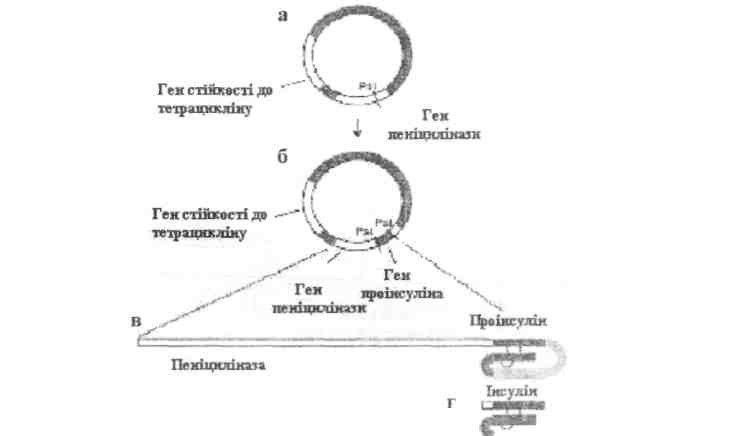
Рис. 38. Біосинтез інсуліну пацюка у клітинах Е.соїі, що були
сконструйовані (за ОіІЬегІє.а., 1980):
а) карта плазміди рВК322 із двома генами - пеніцилінази і стійкості до тетрацикліну;
б) карта, що отримана під час визначення послідовності кДНКрекомбіннантноїплазміди у клоні Е.соli, який продукує інсулін;
в) гібридний білок;
г) біологічно активний інсулін після видалення пеніцилінази і сегменту проінсуліну
Удосконалювання техніки одержання генно-інженерних штамів-продуцентів за допомогою різних прийомів (ампліфікацією плазмід, інкапсуліруванням рекомбінантних ДНК, що вводять, пригніченням протеолітичної активності реципієнтних клітин) дозволило одержати високі виходи гормону, до 200 мг/л культури. Медико-біологічні йклінічні випробування генно-інженерного білка показали придатність препарату, і у 1982 р. його було допущено до виробництва в багатьох країнах.
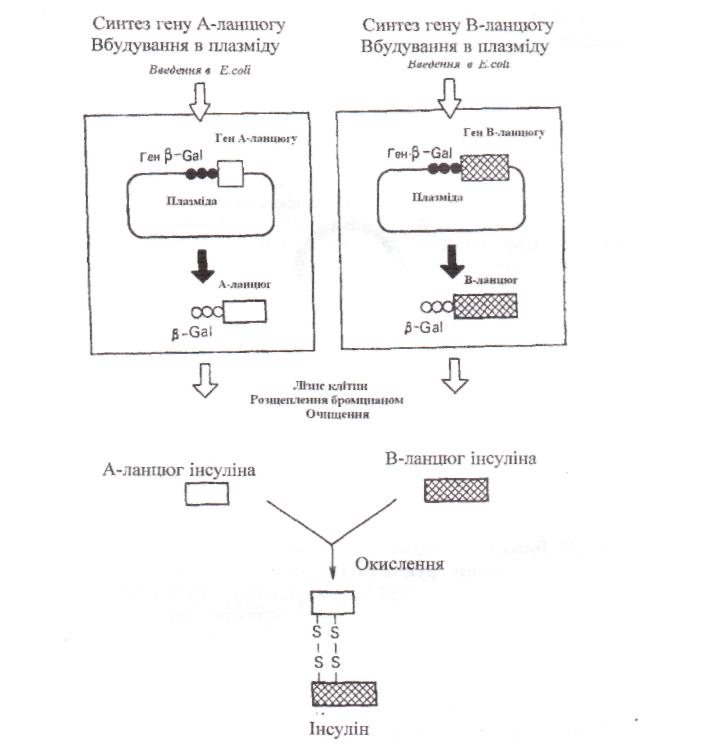
Рис. 39. Отримання інсуліну людини на основі рекомбінантних ДНК (МШег, Вахїег, 1980)
Дата публикования: 2014-11-19; Прочитано: 1067 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
