 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Рестрикционный анализ молекул ДНК
|
|
Огромные возможности рестриктаз можно проиллюстрировать на следующем примере. Рассмотрим двухцепочечную репликативную форму бактериофага фХ174. Он содержит два ковалентно связанных комплементарных кольца, из 5386 нуклеотидов каждое. Чистый препарат ДНК состоит из гомогенных молекул фага. Теперь представим себе, что этот препарат подвергается действию эндонуклеазы, однократно разрезающей двойную спираль кольца без какой-либо специфичности в отношении точки разреза. В результате мы получим препарат ДНК, содержащий линейные молекулы 5386 различных типов, т. е. препарат, совершенно бесполезный с точки зрения анализа нуклеотидных последовательностей. Напротив, если при этом используется рестриктаза Pst I, разрезающая палиндромную последовательность GTGCAG (выписана последовательность нуклеотидов лишь в одной цепи двойной спирали), то получается гомогенный препарат линейных молекул ДНК длиной до 5386 нуклеотидов каждая, упорядоченных в одной и той же последовательности. Геном фХ174 содержит лишь один сайт, узнаваемый рестриктазой Pst I. В геноме фХ174 есть сайты, узнаваемые многими другими ферментами, перечисленными в табл. 9.1. Количество и локализация сайтов для каждой рестриктазы строго определены. Таким образом, воздействие каким-то ферментом приводит к образованию уже известного количества фрагментов ДНК фиксированного размера. Размер каждого типа фрагментов можно узнать с помощью электрофореза в геле: мелкие фрагменты перемещаются в геле быстрее крупных. Так как фрагменты каждого типа характеризуются одинаковым размером и одинаковой последовательностью нуклеотидов, то нуклеотидную последовательность в каждом из них можно определять отдельно, на выделенном посредством электрофореза в геле препарате. Полную последовательность нуклеотидов в геноме можно затем «собрать» из последовательностей отдельных фрагментов, если знать последовательность самих фрагментов в геноме.
9. Методы работы с ДНК 271
| Рис. 9.6. Электрофоретический анализ рестрикционных фрагментов ДНК. ДНК фага λ инкубировали с различными указанными на рисунке рестриктазами время, достаточное для того, чтобы во всех чувствительных сайтах произошло расщепление нуклеотидной последовательности. Образовавшуюся смесь фрагментов ДНК подвергали электрофорезу в агарозном геле. Полосы идентифицировали в ультрафиолетовом свете после окрашивания геля бромистым этидием. Стартовые точки обозначены жирными стрелками. Интактная ДНК фага λ представляет собой линейную молекулу длиной около 48 500 н. п. При действии рестриктазы Bgl IIвозникают фрагменты длиной 22800, 13600, 9800, 2300 н. п. (они отмечены тонкими стрелками) и 460 н. п. (неразличим). | 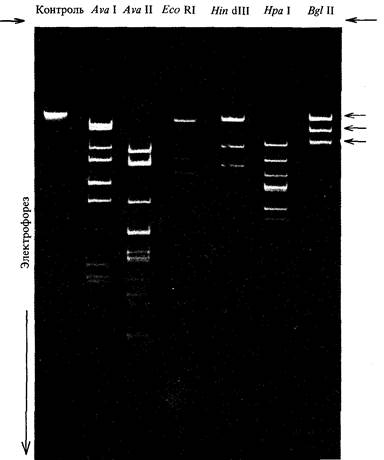
|
Геном фага фХ174 принадлежит к числу самых мелких и наиболее хорошо изученных (см. гл. 7), и именно для этого генома в 1978 году была полностью определена последовательность нуклеотидов с помощью описанного выше подхода (см. гл. 12).
Фаг λ также представляет собой хороший пример того, как можно использовать фрагменты, образующиеся при рестрикции (рестрикты) для описания структуры генома вируса. На рис. 9.6 можно видеть число и размеры фрагментов ДНК, образующихся при действии нескольких различных рестриктаз на геном этого фага. Последовательность фрагментов, образующихся при действии определенной рестриктазы, можно определить с помощью сочетания нескольких методов, цель которых состоит в построении карты сайтов рестрикции генома фага λ. На рис. 9.7 схематически изображена карта сайтов Eco RI и Hin dIII на фоне генетической и физической карт генома фага λ.
Последовательность образующихся при рестрикции фрагментов в интактной молекуле ДНК можно установить несколькими способами. Прежде всего можно использовать неполное расщепление ДНК эндонуклеазами ипоследующее разделение фрагментов электрофорезом. Затем
272 Организация и передача генетического материала
| Рис. 9.7. А. Физическая карта ДНК фага λ, на которой указаны сайты рестрикции для Eco Kl и Hin d III. Б. Размеры фрагментов, образующихся при действии (1) Hin dIII; (2) Eco RIи (3) Hin dIII и Eco RI. [Murray К., Murray Ν. (1975). J. Mol. Biol., 98, 551.] | 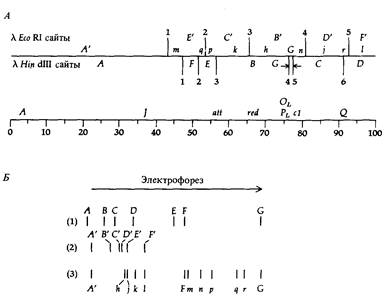
|
выделенные из электрофоретического геля крупные фрагменты снова подвергают действию того же фермента и посредством электрофореза устанавливают идентичность образующихся мелких фрагментов. С другой стороны, фрагменты, возникшие в результате полного расщепления под действием одного фермента, можно извлечь из геля, обработать второй рестриктазой и определить затем с помощью электрофореза размеры образовавшихся мелких фрагментов. Так, например, из рис. 9.7 видно, что выделение фрагмента А под действием рестриктазы Hin dIIIи последующая обработка Eco RI приводят к образованию фрагментов А' и т, возникающих и при одновременном воздействии обоими ферментами.
Сопоставление карты рестрикции с генетической картой можно осуществить, действуя рестриктазами на ДНК, выделенную из различных мутантов фага λ с известными делециями и перестройками в геноме. Сравнивая фрагменты ДНК фагов дикого типа и мутантных, можно определять участки генетической карты фага λ, в которой локализованы соответствующие фрагменты.
Построение рестрикционной карты генома дает возможность разработать стратегию определения последовательности нуклеотидов в генах, представляющих особый интерес. В результате действия нескольких различных ферментов образуются сравнительно мелкие перекрывающиеся фрагменты, содержащие не более нескольких сотен нуклеотидов. Эти фрагменты могут быть выделены в чистом виде, и в них может быть установлена последовательность нуклеотидов. Затем, зная взаимно перекрывающиеся участки последовательностей, можно восстановить последовательность нуклеотидов в крупных фрагментах и в геноме в целом.
9. Методы работы с ДНК 273
Определение последовательности нуклеотидов в ДНК (секвенирование)
Для определения последовательности нуклеотидов в ДНК было создано несколько методов. Во всех этих методах ферменты рестрикции используются для фиксации специфических «точек отсчета». Последовательность нуклеотидов определяют в одноцепочечных фрагментах, состоящих из 100-200 нуклеотидов. Более длинные последовательности составляются из коротких фрагментов с частично перекрывающимися концами. При секвенировании комплементарной цепи проверяется правильность описания последовательности нуклеотидов в первой цепи.
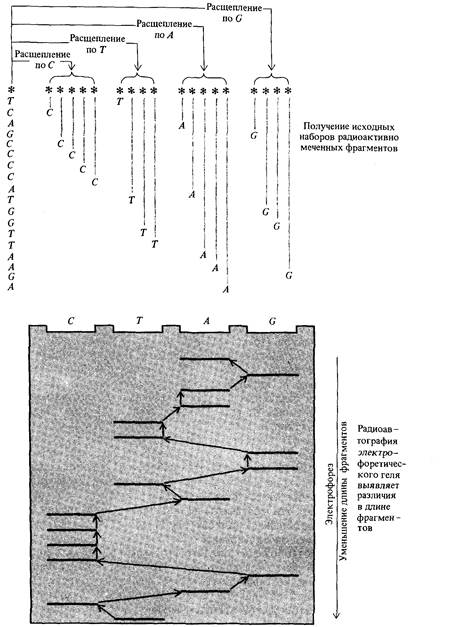
Все методы определения последовательности нуклеотидов основаны на создании исходного набора одноцепочечных фрагментов ДНК, начинающихся в определенной точке и оканчивающихся определенным нуклеотидом, тогда как размеры фрагментов могут быть различны. Каждый такой исходный набор фрагментов затем фракционируют по размерам посредством электрофореза в геле. Фрагменты должны быть помечены радиоактивным изотопом, для того чтобы их размер можно было определять путем радиоавтографии геля. Принципы секвенирования изображены схематически на рис. 9.8.
Методы секвенирования различаются в первую очередь по способу радиоактивного мечения, и кроме того по способу выделения исходного набора фрагментов. Представленная на рис. 9.8 схема основана на методе, разработанном Максамом и Гилбертом. Рестрикционный фрагмент метят радиоактивным изотопом 32Р в 5'-конце с использованием [γ — 32Р] АТР и фермента, называемого полинуклеотидкиназа. Затем комплементарные цепи разделяют и в них независимо определяют последовательность нуклеотидов. На рис. 9.8 изображена одна цепь; звездочка обозначает радиоактивную метку 32Р на 5'-конце. Четыре отдельных образца этого фрагмента подвергают действию различных реагентов, в результате чего образуется четыре исходных набора фрагментов различной величины. Фрагменты каждого из этих наборов на 5'-конце содержат радиоактивную метку, а на другом конце-определенный нуклеотид (см. рис. 9.8). (При этом образуются также наборы фрагментов с одинаковыми З'-концами, однако, эти фрагменты не попадают в поле зрения исследователя, поскольку не содержат радиоактивной метки). Затем четыре исходных набора фрагментов подвергают электрофорезу в полиакриламидном геле «бок о бок». Положение каждого фрагмента в геле можно зафиксировать на обычной рентгеновской пленке. При этом обнаруживается набор полос, каждая из которых соответствует фрагменту определенного размера. Изображенная на рис. 9.8 последовательность фрагментов позволяет прямо с рентгеновской пленки считывать последовательность нуклеотидов, начиная с 5'-конца (т. е. снизу). На рис. 9.9 представлены реальные результаты радиоавтографии геля после электрофореза фрагментов. Как указывается в подписи к рисунку, в действительности нет необходимости в том, чтобы разрезание фрагментов исходного набора производилось по одному и тому же нуклеотиду.
274 Организация и передача генетического материала
|
| Рис. 9.8. Основные принципы определения нуклеотидной последовательности нуклеиновых кислот. Меченные радиоактивным изотопом (*) фрагменты одноцепочечной ДНК подвергают химической обработке четырьмя различными методами, в результате чего образуются четыре группы фрагментов, в каждой из этих групп фрагменты случайной длины оканчиваются определенным нуклеотидом. Все четыре набора фракционируют затем по размерам посредством электрофореза. Нуклеотидная последовательность при этом может считываться непосредственно с радиоавтографа электрофоретического геля (последовательность стрелок от полосы к полосе на диаграмме). |
9. Методы работы с ДНК 275
Дата публикования: 2014-11-18; Прочитано: 2841 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
