 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Токсиканты, вызывающие иммуноаллергические гемолитические анемии 7 страница
|
|
Хронические процессы, развивающиеся со стороны нервной системы в результате острого, подострого или хронического воздействия токсикантов можно классифицировать в соответствии с повреждаемыми элементами нервной системы, характером повреждения нервных образований и механизмами, лежащими в основе патологии. Наиболее удобна морфологическая классификация (таблица 23).
Таблица 23. Характеристика хронических нейротоксических процессов
| Тип | Поражаемая структура | Патологическая реакция | Признаки | Примеры |
| 1. | Тела нервных клеток | Гибель нервных клеток (токсическая нейронопатия) | Быстрое начало, часто исключительно нарушение чувствительности | Метилртуть Адриамицин Талий Тетраэтил- свинец |
| 2. | Миелиновая оболочка | Сегментарная демиелинизация (токсическая миелинопатия) | Быстрое начало, преимущественно моторные нарушения | Теллур Триэтил-олово Гексахлор-фенол |
| 3. | Аксон | Аксональная дегенерация (дистальная аксонопатия) | Постепенное начало, моторно-сесорные нарушения, симптомы "носков и перчаток" | ТОКФ Акриламид Ароматические углеводороды |
Частыми формами хронического процесса являются токсические нейропатии. Однако весьма ограниченное количество веществ избирательно действует на периферические отделы нервной системы. Большинство повреждает и структуры ЦНС, поэтому токсическим нейропатиям не редко сопутствуют признаки энцефалопатии.
В основе хронических процессов, как правило, лежат нарушения пластического обмена в нервной системе, сопровождающиеся её структурно-морфологическими изменениями. Механизмы действия токсикантов, благодаря которым они вызывают нарушение пластического обмена, многообразны и малоизученны. Многообразие механизмов отражается в особенностях течения заболеваний. Так, при хронической интоксикации свинцом, в клинике преобладают признаки моторных нарушений. Трихлорэтилен вызывает поражение тройничного и лицевого нервов, сочетающееся с церебральной патологией. Хроническое отравление мышьяком сопровождается полиневропатией с выраженным болевым синдромом. Фосфорорганические инсектициды могут вызвать отсроченную нейропатию (скрытый период: 1 - 3 недели и более).
Однако, не смотря на различия механизмов поражения, и целый ряд особенностей течения патологии, проявления токсического процесса как правило близки и в большей степени зависят не от механизма действия токсикантов, а от анатомического образования, на которое они подействовали. Очень часто процесс прогрессирует и после прекращения действия токсиканта.
Токсические нейропатии проявляются сегментарной демиелинизацией (токсической миелинопатией) и аксональной дегенерацией (токсической дистальной аксонопатией) (таблицы 23).
Основные признаки этих форм патологии представлены на таблице 24.
Таблица 24. Признаки периферических нейропатий
| Сегментарная демиелинизация | Аксональная дегенерация |
| - деструкция миелиновой оболочки; - вторичное поражение нервного волокна; - снижение скорости проведения нервного импульса; - возможна относительно быстрая полная регенерация | - дистальная дегенерация аксона; - вторичная дегенерация миелиновой оболочки; - на ранних стадиях скорость проведения нервного импульса в пределах нормы, но снижена амплитуда потенциала действия; - денервация мышечных групп; - восстановление медленное и неполное |
Очень многие токсиканты вызывают смешанную форму хронического нейротоксического процесса.
4.2.1. Токсическая сегментарная миелинопатия
Миелинобразующие клетки весьма уязвимы для действия токсикантов, поскольку обладают большой площадью поверхности и объёмом цитоплазмы, в котором необходимо поддерживать определённый уровень обменных процессов.
Ключевыми характеристиками сегментарной миелинопатии являются: преимущественное поражение отростков миелинобразующих клеток и малая чувствительность к действию токсикантов перикариона клеток Шванна; более существенное повреждение нервных волокон с большим диаметром и большими промежутками между перехватами Ранвье; более раннее повреждение дистальных отделов нервных стволов; хорошая способность к регенерации повреждений и относительно быстрая ремиелинизация волокон, проходящая даже в период продолжающейся аппликации токсиканта при его хроническом воздействии.
При интоксикациях некоторыми веществами (ацетилэтил-тетраметил-тетралин - АЭТТ, триэтилово, изониазид и др.) нарушения отмечаются не только в периферических нервных стволах, но и в ЦНС.
4.2.2. Токсическая дистальная аксонопатия
Дистальная аксонопатия - наиболее частая форма поражения периферического отдела нервной системы токсикантами. До настоящего времени этот вид патологии и в эксперименте и в клинических условиях изучен недостаточно глубоко.
Перечень некоторых веществ, способных вызывать токсические аксонопатии у человека представлены на таблице 25.
Таблица 25. Вещества, вызывающие токсические аксонопатии у человека
| Лекарства | Пестициды | Производственные токсиканты |
| амитриптилин амфетамин дапсон дифенилгидантион дисульфирам винбластин винкристин изониазид нитрофурантион пенициллин хлорамфеникол хлорохин цисплатин | ДДТ диэльдрин динитрофенол монобромметан петахлорфенол полисульфид бария ФОИ (карбафос, дихлофос, лептофос и др.) | акриламид бензол гексан гидразин дихлорбензол метилбромид метилбутилкетон мышьяк галогенированные бифенилы свинец сероуглерод талий ТОКФ тетрахлорэтан трихлорэтилен четыреххлористый углерод этиленоксид |
В большинстве случаев проявления отравлений мало специфичны и характеризуются знаками симметричной сенсомоторной полинейропатии. При электронной микроскопии пораженных нервов выявляется скопление нейрофиламентов в областях локализации перехватов Ранвье.
Патологические изменения первоначально формируются в виде мультифокальных поражений дистальных отделов длинных миелинезированных аксонов большого диаметра (мотонейроны). Особенно уязвимы волокна сидалищного нерва и в частности проводники, иннервирующие икроножные мышцы. Поскольку первоначально в процесс вовлекаются лишь дистальные отделы нервных волокон, пострадавший в течение некоторого времени может полностью сохранять работоспособность. Дегенеративные изменения аксона постепенно распространяются проксимально в сторону тела нервной клетки. Нарастает слабость соответствующих групп мышц. Так как мотонейроны поражаются диффузно, и в структуре нервного ствола сохраняется большое число интактных волокон, не смотря на выраженную клинику интоксикации, скорость проведения импульса по нерву изменяется мало. Аксональные нейропатии, как правило, сопровождаются вторичной демиелинизацией нервных стволов.
Нарушение чувствительности также отмечается первоначально в дистальных отделах конечностей. Это проявляется потерей чувствительности в области кистей и стоп (симптом "носков и перчаток"). Постепенно в процесс могут вовлекаться и нейроны чувствительных ганглиев задних корешков спинного мозга.
Поражения вегетативных волокон встречаются крайне редко.
Последовательность событий, развивающихся при формировании токсических нейропатий, достаточно типична. Характерны: периодически возникающее чувство онемения конечностей; повышение болевой чувствительности кожных покровов дистальных отделов конечностей; болезненность по ходу нервов верхних и нижних конечностей; парестезии; слабость мышечных групп, развивающаяся от периферии к центру, преимущественно разгибателей; атаксия; атрофия мышц конечностей.
Регенерация аксона (в отличии от ремиелинизации) проходит медленно со скоростью около 1 мм в сутки. В этой связи процесс восстановления затягивается на месяцы, и даже годы.
Многие токсиканты повреждают не только периферические, но и центральные нервные проводники. В ЦНС также страдают структуры, образованные длинными аксонами большого диаметра: кортикоспинальный, спиноцеребеллярный тракты. Проводящие пути, образуемые короткими отростками малого диаметра (оптический нерв), вовлекаются в патологический процесс в последнюю очередь, и, как правило, лишь при хронических интоксикациях. Нарушения в ЦНС и ПНС могут формироваться практически одновременно, при этом центральные эффекты часто маскируются более выраженными периферическими эффектами. Однако после восстановления функций периферических нервных стволов могут выявляться признаки поражения ЦНС: спастичность, атаксия, атрофия оптического нерва, нарушение умственных способностей.
Интимные механизмы действия большинства токсикантов не известны. Отмечается, что вещества, способные вызывать аксональную дегенерацию, угнетают активность таких ферментов, как нейрэстераза (см. ниже), а также глицеральдегид-3-фосфат дегидрогеназа, необходимых для обеспечения энергетических и пластических процессов в нервной клетке.
Три-О-крезилфосфат (ТОКФ)
Классическим представителем веществ, вызывающих дистальную аксонопатию является три-О-крезилфосфат (рисунок 20). Это маслянистая жидкость, хорошо растворяющаяся в липидах и органических растворителях. Вещество широко используется в качестве термостабильной добавки к машинным маслам и пластификатора при производстве пластмасс. ТОКФ относится к группе ФОС, но антихолинэстеразным действием не обладает.
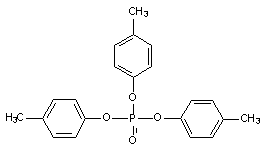
Рисунок 20. Структура молекулы три-О-крезилфосфата
Отчетливая картина интоксикации развивается при приёме внутрь около 120 мг ТОКФ (т.е. 2 мг/ кг массы). Анализ показывает, патология различной степени тяжести может развиваться и от значительно меньших доз вещества (более 0,5 мг). В 1940 году 89 солдат Шведской армии получили отравление ТОКФ, в результате использования в пищу масла, контаминированного токсикантом. Клиника отравления у всех пострадавших была сходной. Спустя 1 - 12 часов развились признаки гастроэнтерита, характеризующиеся рвотой (90%), болями в области живота, поносом. Явления продолжались в течение 24 - 36 часов. Затем, после латентного периода продолжавшегося 13 - 27 суток появились парестезии, а потом и вялые парезы дистальных групп мышц нижних конечностей (сначала разгибателей). Позже присоединились явления слабости мышц верхних конечностей (46%), бедер (41%), области таза (43%). Нарушение сухожильных рефлексов отмечалось у всех пострадавших (коленный рефлекс, ахилов рефлекс). Чувствительные и черепно-мозговые нервы в патологический процесс вовлечены не были. У 26% пострадавших отмечено нарушение вегетативных функций: парез мочевого пузыря, импотенция. Проявления интоксикации достигли максимума к 3 - 4 неделе заболевания. Затем наступила ремиссия, однако через три месяца от начала интоксикации появились признаки нарушения ЦНС: спастичность и атаксия. У 52 пораженных полного восстановления функций не произошло.
В эксперименте установлено, что в основе патологического процесса лежат выраженные морфологические нарушения отдельных нервных волокон. Они характеризуются появлением участков дегенерации по ходу аксонов. Демиелинизация волокон не отмечается. При электронной микроскопии пораженных участков нервного волокна выявляется дезинтеграция нейрофиламентов, скопление мембранных и гранулярных патологических включений. Отмечаются морфологические нарушения в синапсах передних рогов спинного мозга, характеризующиеся набуханием и разрывами везикулярных мембран. Полагают, что повреждение внутриклеточных мембран нейронов обусловлено взаимодействием ТОКФ с мембран-связанной нейрэстеразой, участвующей в их образовании. Необходимым условием развития нейропатии является существенное (около 80%), необратимое ингибирование энзима.
4.2.3. Перикариальная токсическая нейронопатия
Количество токсикантов, вызывающих повреждение перикариона нервных клеток, относительно невелико. К их числу относятся: метилртуть, ртуть, адриамицин, талидомид, алюминий, винкристин, сероуглерод, трихлорэтилен, тетраэтилсвинец (ТЭС) и др. Периферические нейропатии, вызываемые этими веществами, как правило, сопровождаются признаками поражения мозга, а для некоторых токсикантов именно центральное действие является основным (ТЭС).
Метилртуть
Благодаря высокой растворимости в липидах, метилртуть легко проникает через гистогематические барьеры и клеточные мембраны. Связь ртути с метильными радикалами достаточно прочна и поэтому значительная часть вещества выводится из организма в неизменённом виде. Поскольку выделение с мочой затруднено, а выводящееся с желчью вещество подвергается частичной реабсорбции в кишечнике, период его полувыведения продолжителен и у человека может достигать 200 суток.
Первые упоминания о массовых отравления метилртутью относятся к 1914 году, когда препарат стали использовать в качестве фунгицида для обработки семенного зерна. Источником метилртути в окружающей среде может стать биотрансформация неорганических соединений ртути биотой. Так, трагедия Минамата была связана с загрязнением неорганической ртутью прибрежных морских вод Японского моря. В результате биопревращений её планктоном образовывалась метилртуть, накопившаяся затем в большом количестве в тканях промысловых рыб. Использование зараженной рыбы в пищу привело к массовому отравлению людей.
Однако самой масштабной была трагедия в Иране, где население использовало в пищу продукты, приготовленные из зерна, обработанного фунгицидом. Число жертв исчислялось тысячами.
Метилртуть вызывает очаговую дегенерацию нейронов гранулярного слоя мозжечка и коры головного мозга, особенно зрительных областей. Первичные сенсорные нейроны также вовлекаются в патологический процесс.
Патология нервной системы, вызываемая метилртутью, изучена в опытах на экспериментальных животных. Установлено, что введение вещества крысам в дозе 7,5 мг/ кг в течение 8 дней приводит к поражению тел нейронов дорзальных ганглиев. При микроскопии уже на вторые сутки выявляется дегрануляция шероховатого эндоплазматического ретикулума в периферических отделах цитоплазмы пораженных нейронов. С увеличением дозы усиливается выраженность выявляемых изменений. К 8 суткам появляются отчетливые признаки дегенерации нейронов. Определяется фрагментоз нервных волокон на всём их протяжении. Поражаются волокна, формирующие как нервные стволы, так и проводящие пути спинного мозга. Причем деструктивные процессы захватывают как задние, так и передние отделы. Выявляемые признаки аксональной дегенерации, в настоящее время, рассматриваются как вторичные проявления нейронопатии. Поражение крупных ганглионарных клеток метилртутью объясняют быстрым накоплением вещества именно в этих нервных структурах, вследствие высокой проницаемости гематоневрального барьера в ганглиях задних корешков спинного мозга.
В опытах на кроликах (7,5 мг/ кг в течение 4 дней), помимо указанных, удаётся выявить изменения со стороны и других структур ЦНС. Так, определяются структурные изменения звёздчатых и корзинчатых клеток молекулярного слоя коры мозжечка, нейронов 2,3,4 слоев теменной и затылочной областей коры головного мозга. Морфологическим субстратом повреждения нервных клеток является дегрануляция и разрушение шероховатого эндоплазматического ретикулума. Характерная особенность нервных клеток ЦНС, чувствительных к метилртути - малые размеры, большой объём ядра клетки. Будучи цитоплазматическим ядом, вещество в большей степени поражает клетки с тонким слоем цитоплазмы
В ходе биохимических исследований удалось показать, что метилртуть - рибосомальный яд. Под влиянием токсиканта нарушается включение меченых аминокислот в структуру синтезируемых нервными клетками белков. Вещество характеризуется высоким сродством к SH-группам. Из 120 рибосомальных сульфгидрильных групп примерно половина имеет функциональное значение для реализации процесса белкового синтеза. Находясь в активном состоянии, эти группы наиболее активно вступают во взаимодействие с токсикантом.
Тетраэтилсвинец
Тетраэтилсвинец (ТЭС) - Pb(C2H5)4 - маслянистая летучая жидкость, практически не растворимая в воде, но хорошо растворяющаяся в жирах и органических растворителях. ТЭС используют, как антидетонатор, добавляемый в составе этиловой жидкости к некоторым сортам бензина. Вещество может проникать в организм ингаляционно и через неповрежденную кожу, а также с продовольствием, контаминированным токсикантом. В течение 3 - 4 суток ТЭС в неизмененном виде обнаруживается в крови и тканях. В результате метаболизма в печени и других тканях ТЭС превращается в триэтилсвинец, с образованием которого и связывают развитие патологии. Триэтилсвинец длительно (до 20 суток) циркулирует в крови, постепенно накапливаясь в печени и ЦНС. Наибольшее количество вещества депонируется в таламусе, гипоталамусе, стриатуме, фронтальных отделах коры больших полушарий мозга - структурах, плотно иннервируемых дофаминергическими нервными окончаниями. В дальнейшем вещество разрушается до неорганического свинца, который частично откладывается в тканях, а частично выводится с мочой и калом.
Контакт ТЭС с покровными тканями, как правило, проходит незамеченным, поскольку вещество не обладает раздражающим или прижигающим действием. Проявления поражения развивается после скрытого периода, который продолжается от нескольких часов до 10 суток. Наиболее ранними признаками поражения являются гипотония, гипотермия, брадикардия, повышенная потливость, саливация, головокружение - проявления повреждений высших центров регуляции вегетативного отдела нервной системы. Постепенно состояние ухудшается, появляются иллюзии (извращение вкуса), галлюцинации - зрительные, слуховые, тактильные (ощущение инородного тела во рту), депрессия, тревожный сон с кошмарными сновидениями. При тяжелых интоксикациях отмечается: расстройства речи, шаткая походка, нистагм, гиперрефлексия, птоз, дрожание век, языка, пальцев рук, парез лицевого нерва, нарушение интеллекта, резкое психомоторное возбуждение, бред. На высоте интоксикации возможна смерть от остановки сердечной деятельности. В благоприятных случаях выздоровление наступает через 2 - 3 месяца, но редко бывает полным. Как правило, явления энцефалопатии отмечаются в течение длительного времени.
Механизм токсического действия ТЭС до конца не выяснен. Полагают, что в основе токсического процесса лежит нарушение пластического обмена в клетках мозга, обусловленное ковалентным связыванием свинца с биомолекулами, в состав которых входят амино-, карбокси-, имидазол-, фосфатные и SH-группы. Результатом такого взаимодействия является денатурация молекул, нарушение их свойств и функций. Свинец конкурирует с двухвалентными металлами, такими как Ca2+ и Zn2+. В итоге угнетается активность большого количества энзимов (аденилатциклазы, Na-K-АТФазы), нарушается синтез белка в клетках, повреждаются процессы, проходящие в митохондриях (угнетение окисления жирных кислот, декарбоксилирования пировиноградной кислоты, снижаются запасы макроэрогов) и т.д. Существенно страдает обмен дофамина в ЦНС: увеличивается потребление тирозина, усиливается выброс дофамина, нарушается обратный захват нейромедиатора. Это указывает на серьёзное повреждение дофаминэргических медиаторных структур мозга. При тяжелых интоксикациях происходит гибель нервных клеток, что лежит в основе органического синдрома поражения мозга.
Алюминий
Алюминий чрезвычайно широко распространённый элемент. Контакт с ним человека неизбежен. Вместе с тем случаи острой или хронической интоксикации веществом неизвестны. Это связано с неспособностью алюминия проникать через барьеры, образованные кожей, эпителием желудочно-кишечного тракта и легкими.
Однако в особых условиях возможна интоксикация алюминием. Так, в литературе описан случай энцефалопатии, сопровождавшийся повышением содержания алюминия в ткани головного мозга у больного, длительно находившегося на гемодиализе. Для контроля уровня фосфатов в плазме крови использовали алюминий-содержащий гель.
Увеличение содержания алюминия в ткани мозга обнаружено у лиц с болезнью Альцгеймера. Необходимы дальнейшие наблюдения и исследования установления роли алюминия в патологии мозга.
Алюминий вызывает специфические изменения нейрофибрил нейронов. Впервые эффект был установлен при интрацеребральном введении кролику антигена, связанного с адъювантом, содержащим фосфат алюминия. При поражениях изменённые нейроны обнаруживаются практических во всех структурах мозга. При электронной микроскопии в поврежденных нервных клетках регистрируются участки локального просветления цитоплазмы, представляющие собой конгломерат нейрофиламентов. В эксперименте изменения нейронов удаётся воспроизвести и при подкожном введении животному больших доз солей алюминия.
Таллий
Основные источники загрязнения окружающей среды таллием - цементные заводы, теплоэлектростанции (ТЭС), работающие на угле, плавильные комбинаты, по выпуску меди, цинка, кадмия и свинца. Вода может быть заражена таллием близ металлоплавильных производств. В атмосфере таллий может присутствовать в форме металла, а также оксида и сульфата. Основное производство, использующее таллий - выпуск полупроводников и электрических переключательных устройств.
В 1920 г. в Германии соли таллия начали применять в качестве пестицидов. Действующий агент содержал 2% сульфата таллия. Стойкость вещества в окружающей среде и кумуляция в организме млекопитающих сделали его идеальным родентицидом. Именно в качестве пестицида таллий стал причиной отравления человека. В 1965 году использование таллия в качестве пестицида в США было запрещено, однако в других странах мира он продолжает использоваться с этой целью. Таллий также применяют для изготовления оптических линз, красителей, пигментов, фейерверка. Таллий стал важнейшим веществом в производстве сверхпроводников.
В развитых странах основные области потребления таллия - это производство электроники, фотоэлектрических элементов, ламп, сцинтилляционных счетчиков, полупроводников. Вещество также используют, как катализатор в химическом синтезе, в производстве сверхпроводников, искусственных ювелирных изделий.
Новая волна широкого использования таллия в качестве сверхпроводника и катализатора, заставляет внимательно изучать токсичность вещества.
Основной причиной легких отравлений таллием является ингаляция воздуха, содержащего таллий или потребление фруктов, обработанных этим веществом. Поскольку метал обладает выраженными кумулятивными свойствами и абсорбируется через кожу (также как и ЖКТ), необходимо учитывать свойства этого вещества, как потенциального экотоксиканта.
Острые тяжелые отравления таллием, как правило, являются следствием случайного или преднамеренного приема солей металла per os. На производстве возможны также ингаляционные воздействия и действие при попадании на кожу. Всасывание вещества осуществляется быстро (в течение 1 часа) и практически полностью (в опытах на грызунах - до 100%). Соединения таллия в руках неопытного и не проинструктированного человека представляют большую опасность.
После проникновения в кровь таллий распространяется по организму, проникая внутрь клеток. Наибольшее количество металла скапливается в почках (в медулярном слое). Высокое содержание металла определяется в сердечной мышце, печени и волосах. Концентрация таллия в жировой ткани и мозге низкая. В крови металл равномерно распределяется между плазмой, лимфоцитами и эритроцитами. Таллий проникает через плаценту, однако содержание его в тканях плода - незначительно.
Основные пути выделения таллия - через почки и ЖКТ. Период полувыведения из организма человека составляет около 30 суток.
Таллий - сильный нейротоксикант. Как правило, клинические проявления острой интоксикации нарастают медленно в течение нескольких недель и характеризуются развитием острых и подострых эффектов (таблица 26).
Таблица 26. Основные проявления интоксикации таллием
| 1. Острые эффекты: - Тошнота - Рвота - Боли в животе - Тремор - Мышечная атрофия - Параличи - Атаксия - Психоз - Судороги - Кома 2. Подострые эффекты: - Запоры - Желудочно-кишечные кровотечения - Дерматит (эритема, изменение ногтей, шелушение кожи, линии Мии) - Парестезия - Восходящая нейропатия - Полиневрит - Мышечная слабость - Нейропатия черепно-мозговых нервов (птоз, офтальмоплегия, ретробульбарный неврит, неврит лицевого нерва) - Атаксия - Утомляемость - Эмоциональные нарушения - Психозы |
При пероральном отравлении первые симптомы - тошнота и рвота. Затем, в течение последующих 7-14 дней развиваются боли в животе, запоры, ощущение тяжести в желудке, кровотечение.
Неврологические симптомы, как правило, появляются через неделю и характеризуются невритами, преимущественно нижних конечностей. Через 1-3 недели после воздействия болезненность по ходу нервов усиливается, развивается атаксия, тремор. Мышечные рефлексы сохраняются обычно достаточно долго. В процесс вовлекаются краниальные нервы.
Поражение блуждающего нерва сопровождается тахикардией, умеренной гипертензией, парезом кишечника. Нарушения, выявляемые при электрокардиографии, напоминают состояние гипокалиемии.
Психические расстройства проявляются депрессией и психозом.
При тяжелых интоксикациях довольно быстро развиваются галлюцинации, делирий, судороги, кома. Смерть развивается в результате нарушений сердечной деятельности и функций почек.
Выздоровление происходит медленно и растягивается на месяцы.
При хроническом воздействии, как правило, развивается стойкая нейропатия, сопровождающаяся слабостью мышц нижних конечностей, болезненностью по ходу нервов, нарушениями интеллекта, потерей волос. Аллопеция может развиваться спустя месяцы после воздействия таллием. Восстановление растягивается на многие месяцы.
Механизм действия вещества изучен недостаточно. Известно, что таллий и калий конкурируют за механизмы переноса ионов через биологические мембраны, опосредованные активностью Na-K-АТФазы. Таллий может замещать К+ и выступать его конкурентом и в других жизненно-важных процессах.
В настоящее время отсутствуют эффективное лечение отравлений таллием. В опытах на животных известной активностью обладали диэтилдитиокарбамат (дитиокарб) и дифенилтиокарбазон (дитизон). Однако использование этих комплексонов у людей выявили их слабую эффективность.
Рекомендуют сочетанное применение хлористого калия с активированным углем. Калий вытесняет Tl из связи с внутриклеточными рецепторами. Рекомендуют дополнять терапию назначением прусского голубого (ферроцианоферрат калия). Препарат назначают per os в дозе 250 мг/кг в сутки в 50 мл 15% маннитола в два приема (применяли до 10 грамм два раза в день). Прусский голубой не всасывается в ЖКТ. Калий, вытесняет Tl, а последний связывается с ферроцианоферратом и выводится из организма.
Адриамицин
Адриамицин - используется в клинической практике как цитостатик. Вещество известно, как нейротоксикант, селективно повреждающий нейроны ганглиев дорзальных корешков спинного мозга и симпатические нейроны. Вещество связывается с ДНК нейронов, нарушает синтез РНК. Опыты с введением меченного 3Н-лейцина экспериментальным животным показывают существенное замедление процесса его ассимиляции нервными клетками, что указывает на нарушение процессов синтеза белка.
Нейротоксический эффект получен только в эксперименте при одномоментном введении большой дозы препарата. При интоксикации выявляются дегенеративные изменения периферических нервов, дорзальных корешков и дорзальных колонн спинного мозга. При микроскопии определяются деструктивные изменения в телах нейронов, состоящие в смещении ядра клетки, увеличении числа цитоплазматических нейрофиламентов, образовании мембрансвязанных полостей.
Избирательное повреждение нервных клеток симпатических ганглиев дорзальных корешков спинного мозга связано с высокой сосудистой проницаемостью этих регионов нервной системы. Гематоэнцефалический барьер не проницаем для этого вещества.
Винкристин
Винкристин - цитотоксический агент, используемый для лечения лейкемии и других неопластических процессов. Вскоре после введения препарата в клиническую практику была обнаружена его способность вызывать нейронопатии. В эксперименте на лабораторных животных эффект воспроизводится при внутрицеребральном введении вещества. При микроскопическом исследовании в поврежденных нейронах обнаруживаются скопления нейрофиламентов диаметром 9 - 10 нм. Цитотоксическое действие винкристина связывают с его способностью повреждать микротрубочки, формирующиеся в клетке в метафазе митоза. Вещество присоединяется к мономерам, из которых формируются микротрубочки, препятствуя процессу их полимеризации. В нервных клетках, как полагают, также происходит нарушение образования микротрубочек, имеющих важное значение для обеспечения аксонального тока пластических элементов цитоплазмы нейронов.
Однако не исключено, что механизм нейротоксического действия винкристина может быть и иным.
5. Оценка нейротоксичности в эксперименте
Современная нейробиология располагает огромным арсеналом прецизионных методов, позволяющих всесторонне оценить функциональное состояние нервной системы человека и экспериментальных животных. Многие из этих методов требуют высокой квалификации специалистов, дорогостоящего оборудования и применяются лишь в специальных токсикологических исследованиях. Однако, оценка нейротоксичности ксенобиотика может быть осуществлена и в ходе достаточно простых поведенческих, биохимических, электрофизиологических, патологоанатомических исследований.
Дата публикования: 2014-11-04; Прочитано: 449 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
