 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Тема 1. I род электродных процессов. Электродные процессы и электродвижущие силы в гальванических элементах
|
|
Цели, задачи:
На фактическом уровне получения знаний:
1. Предмет изучения электрохимии. Электродный потенциал металла, механизм его возникновения, способы измерения и зависимость от температуры и концентрации ионов. Ряд стандартных электродных потенциалов Н.Н. Бекетова, его использования в электрохимии.
2. Гальванический элемент как химический источник тока. Принципиальная схема. Анод и катод как проводники первого рода, анодный и катодный процессы в гальваническом элементе. Функции внешней и внутренней цепей.
3. Определение работы гальванического элемента.
На операционном уровне получения знаний:
Обучить студента:
1. Использовать ряд стандартных электронных потенциалов Бекетова;
2. Использовать уравнение Нернста для электродного потенциала и расчета величины работы гальванического элемента;
3. Описывать уравнения электродных реакций для гальванических элементов и аккумуляторов;
4. Определять работу гальванического элемента с использованием энергии Гиббса;
5. Характеризовать принцип работы концентрационного элемента.
На аналитическом уровне получения знаний:
Обучить студента:
1. Определять анодную и катодную области, используя значения стандартных и равновесных электродных потенциалов;
2. Определять направление перемещения электронов во внешней цепи;
3. Составлять гальванические элементы, как с использованием различных металлов так и концентрационные. Характеризовать работу аккумулятора;
4. Приводить формулу электрохимической цепи в ионной форме;
5. Определять Э.Д.С. электрохимической цепи как с помощью энергии Гиббса, так и на основании электродных потенциалов.
Фактический материал:
I. Электрохимия как наука, изучающая взаимопревращения химической и электрической энергии. Два рода проводников электрического тока: а) с электронным типом проводимости; б) с ионным типом проводимости.
II. Электродный потенциал (φ, В), механизм его возникновения. Стандартный водородный электрод. Способы измерения электродного потенциала, его зависимость от различных факторов, выражаемая уравнением Нернста 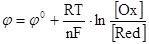 , где
, где 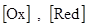 - концентрации окисленной и восстановленной формы электрохимической системы, соответственно. По восстановительной способности все металлы характеризуются значениями стандартных электродных потенциалов
- концентрации окисленной и восстановленной формы электрохимической системы, соответственно. По восстановительной способности все металлы характеризуются значениями стандартных электродных потенциалов 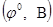 , систематизированных Н. Н. Бекетовым по снижению восстановительной активности.
, систематизированных Н. Н. Бекетовым по снижению восстановительной активности.
III. Гальванические элементы как устройства, в которых происходит превращение химической энергии самопроизвольно протекающих окислительно-восстановительных реакций в электрическую. Устройство, принцип действия и Э.Д.С (Е, В) как разность электродных потенциалов катода и анода Е = 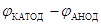 .
.
Электрохимическая запись гальванического элемента Якоби-Даниэля анод (-)Zn |ZnSO4||CuSO4|Cu(+) катод; электродные процессы:
а) на аноде: 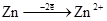
б) на катоде: 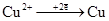
Работа обратимого гальванического элемента соответствует изменению энергии Гиббса для данной окислительно-восстановительной реакции
∆ G0 = - 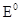 n F.
n F.
Выводы по теме:
1. На границе металл – водный раствор соли металла, всегда возникает скачек потенциала, величина и знак которого зависят от природы металла, от концентрации раствора и температуры процесса.
2. Все металлы по их восстановительной способности располагаются в ряд стандартных электродных потенциалов Бекетова.
3. Используя любые два металла можно составить гальванический элемент как источник электроэнергии.
4. Э.Д.С. гальванического элемента будет тем больше, чем более различными по природе являются металлы, его составляющие.
Вопросы для самопроверки:
1. Гальванический элемент состоит из металлического цинка, погруженного в 0,1 М раствор нитрата цинка, и металлического свинца, погруженного в 0,02 М раствор нитрата свинца. Вычислить Э.Д.С. элемента, написать уравнение электродных процессов, составить электрохимическую цепь.
2. Вычислить потенциал серебряного электрода в насыщенном растворе Ag Br (Пр = 6∙10-13), содержащем кроме того, 0,1 моль/л бромида калия.
3. Вычислить активность ионов H+ в растворе, в котором потенциал водородного электрода равен – 82 мВ.
4. Определить Э.Д.С. гальванического элемента
Ag|AgNO3(0,001М)||Ag NO3 (0,1М)|Ag
В каком направлении будут перемещаться электроны во внешней цепи?
5. Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом – анодом. Написать уравнение реакций, происходящих при работе этих элементов, и вычислить значение стандартных Э.Д.С.
6. Рассчитать электродные потенциалы магния в растворе его соли при концентрациях иона Mg2+ 0,1; 0,01 и 0,001 моль/л.
Дата публикования: 2014-11-03; Прочитано: 362 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
