 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
В изохорных процессах вся теплота, сообщенная системе или выделенная ею, определяется изменением внутренней энергии системы
|
|
U2 – U1 = ΔU,
где U1 – внутренняя энергия начального состояния системы;
U2 – внутренняя энергия конечного состояния системы.
В изобарных процессах для поддержания давления постоянным приходится изменять объем системы, т.е. увеличивать или уменьшать ее размеры (рис. 7). Говоря другими словами – совершать работу, которая определяется по формуле:
А = р · S · h = р · DV,
где р – давление системы;
ΔV – изменение объема системы (V2 – V1).
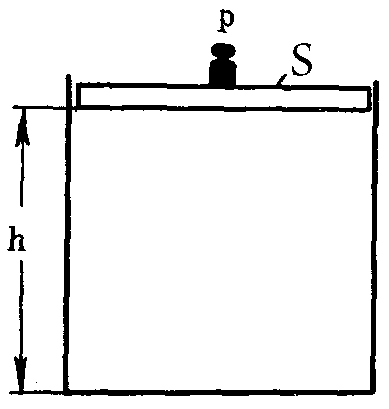
Рис. 7. К пояснению физического смысла энтальпии
В связи с этим в изобарных процессах выделяющуюся или затраченную теплоту нельзя определить только изменением внутренней энергии системы, нужно учесть совершенную работу, которая также эквивалентна определенному количеству энергии. В связи с этим в термодинамике используют новую величину – энтальпию или теплосодержание системы Н, определяемую соотношением:
Н = U + рV
Энтальпия больше внутренней энергии на величину работы расширения, совершенной при изменении объема системы от 0 до V. Как и внутренняя энергия, энтальпия является функцией состояния и определить ее абсолютное значение нельзя. Можно только измерить изменение ΔН при переходе системы из одного состояния в другое:
ΔН = Н2 – Н1 = (U2 +рV2) – (U1 + рV1) = U2 – U1 + (рV2 – рV1) =
ΔU + р(V2 – V1) = ΔU + рΔV
Протекание химических реакций сопровождается выделением или поглощением теплоты, которую можно измерить. Это количество теплоты называется тепловым эффектом химической реакции .
Химические реакции, в которых происходит выделение теплоты, называются экзотермическими. Реакции, при протекании которых наблюдается поглощение теплоты, называются эндотермическими.
Для реакций, протекающих при постоянном объеме, тепловой эффект ( QV ) равен изменению внутренней энергии системы:
QV = U2 – U1 = ΔU
Для реакций, протекающих при постоянном давлении, тепловой эффект ( QР ) равен изменению энтальпии системы:
QР = Н2 – Н1 = ΔН = ΔU + А при этом DU = QP – A
Разница между величинами QV и QР может быть достаточно велика для систем, содержащих компоненты в газообразном состоянии. Причем, если в ходе реакции химическое количество газообразных веществ возрастает
N2O3 (г) → NO(г) + NO2 (г),
то QV будет больше, чем QР, на величину работы расширения против внешних сил, которую нужно совершить системой, чтобы давление в ней осталось неизменным. На совершение данной работы необходимо затратить определенное количество выделившейся теплоты.
Величина этой работы, а значит, и разница между QV и QР, определяется соотношением:
QV – QР = рΔV = ΔnRT
где Δn – разность между числом молей газа в конечном и исходном состоянии; R – универсальная газовая постоянная; Т – температура системы.
Для реакций, сопровождающихся уменьшением химического количества газов
2NO(г) + O2 (г) = 2NO2 (г),
наоборот, QР будет больше, чем QV, но теперь уже на величину работы сжатия системы, выполняемую внешней средой. При совершении ее выделится дополнительное количество энергии:
QР – QV = ΔnRT
Если же в ходе протекания реакции химическое количество газообразных веществ не меняется
Н2(г) + Cl2(г) = 2НCl(г),
то QV = QР.
Для реакций, в которых участвуют только жидкие и(или) твердые вещества, различием в QV и QР можно пренебречь, т.к. объем жидкостей и твердых тел при нагревании или охлаждении изменяется незначительно.
Дата публикования: 2014-11-03; Прочитано: 551 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
