 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Материальный баланс на 1т окиси этилена
|
|
| Приход | Расход | ||||
| исходное вещество | кг | м3 | Продукт | кг | м3 |
| Этилен………….. Воздух в том числе: кислород…... азот………… | Окись этилена Этилен ………… Кислород………. Азот …………… | ||||
| Итого: | Итого: |
| параметры | Вариант | |||||||||
| wэ % | 2,5 | 3,5 | 4,5 | 5,5 | 6,5 | |||||
| wв % | 97,5 | 96,5 | 93,5 | 94,5 | 93,5 | |||||
| Х | 0,4 | 0,4 | 0,45 | 0,45 | 0,5 | 0,5 | 0,55 | 0,55 | 0,6 | 0,6 |
| G т |
Пример 3.4. При электрокрекинге природного газа, содержащего w1 = 98% (об.) СН4 и w2 = 2% (об.) N2, в газе выходящем из аппарата, содержится w3 = 15% ацетилена.
Рассчитать материальный баланс процесса на V = 1000 м3 исходного природного газа без учета побочных реакций.
Решение. Получение ацетилена из газообразных углеводородов (главным образом из метана) осуществляется при 1200 - 1600°С:
2СН4 ⇄ С2Н2 + 3Н2 – 380 кДж
Процесс происходит в электродуговых печах при 1600°C и линейной скорости газа 1000 м/с.
В 1000 м3 исходного газа содержится: СН4 – 980 м3, N2 – 20 м3. Процесс идет с изменением объема; при полном превращении метана в ацетилен и в продукционной смеси должно содержаться 25% ацетилена (см. уравнение реакции). Так как по условию в продуктах реакции содержится 15% ацетилена, значит имеет место неполное разложение метана.
Обозначим количество превращенного метана (в м3) через х. Тогда состав смеси, выходящей из печи, можно представить следующим образом:
СН4…………. 980 – х
С2Н2………… 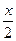
Н2…………... 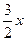
N2…………... 20
______________________
Итого: (1000 + х) м 3
По условию количество ацетилена в газе, выходящем из печи, составляет 15%, т.е.
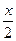 ……………… 15%
……………… 15%
(1000 + х)………. 100%
Решая уравнение, получим

т.е. х = 430 м3 и состав газа после крекинга будет следующим:
С2Н2 …… 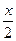 = 215 м3 СН4 …… 980 – х = 980 – 430 = 550 м3
= 215 м3 СН4 …… 980 – х = 980 – 430 = 550 м3
Н2 ……… 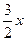 = 645 м3 N2 …….. 20 м3
= 645 м3 N2 …….. 20 м3
Результаты расчетов сведены в таблицу:
Материальный баланс печи крекинга (на 1000 м3 природного газа)
| Приход | Расход | ||||||
| исходное вещество | м3 | кг | % (об.) | продукт | м3 | кг | % (об.) |
| СН4…………. N2 ………….. | С2Н2 ………. СН4 ……….. Н2………….. N2 …………. | 15,0 38,5 45,0 1,5 | |||||
| Итого: | Итого: |
| параметры | Вариант | |||||||||
| w1 % | 95,5 | 96,5 | 97,5 | 95,5 | ||||||
| w2 % | 4,5 | 3,5 | 2,5 | 4,5 | ||||||
| w3 % | 13,5 | 14,5 | 15,5 | 14,5 | 13,5 | |||||
| V м3×103 |
Пример 3.5. Составить материальный баланс хлоратора в производстве хлорбензола (G = 1т хлорбензола), если состав жидких продуктов в % (масс.) следующий: бензола – wб = 65,0; хлорбензола – wх = 32,0; дихлорбензола – wд = 2,5; трихлорбензола – wт = 0,5. Технический бензол содержит w1 = 97,5% (масс.) С6Н6. Технический хлор – w2 = 98% (масс.) Cl2.
Решение. Хлорбензол является полупродуктом для получения различных производных бензола таких как фенол, анилин и др. Получают его, пропуская хлор в жидкий бензол в присутствии хлорида железа (III). По мере образования хлорбензола кроме основной реакции
С6Н6 + Сl2 → С6Н5Сl + НСl (1)
Дата публикования: 2014-11-03; Прочитано: 1202 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
