 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Модифицирующие полимерполисолевые растворы
|
|
Наиболее эффективными промывочные жидкостями для бурения неуплотненных глин являются полимерполисолевые растворы, важнейшими свойствами которых являются их крепящие свойства.
Напомним, что полимерсолевыми растворами мы называем растворы, основными компонентами которых являются:
полимеры-ингибиторы диспергирования, защитные реагенты;
соли одновалентных металлов-ингибиторы гидратации, с весьма подвижными «гидрофобными» катионами, способными проникать в неуплотненные глины на значительную глубину;
соли поливалентных металлов - модификаторы глины, с катионами, способными «сшивать» глинистые частицы или родственные глине по химическому составу анионами, способными достраивать кристаллическую решетку, заполнять поры, повышать плотность и прочность горной породы.
«Сшивающие» анионы и катионы весьма гидрофильные, в контакте с глиной активно взаимодействуют с глинистыми частицами образуя плотный модифицированный слой, который не позволяет поливалентным ионам глубоко проникать в объем глин. Поэтому, как правило, модифицированный слой небольшой толщины.
В результате нейтрализации заряда глинистых частиц катионами, как отмечено выше, происходит их дегидратация и коагуляция с последующим химическим взаимодействием катионов с глинистыми частицами «сшиванием».
Концентрация, ионов при которой происходит полная коагуляция и сшивание частиц (порог коагуляции) зависит от валентности ионов и подчиняется «закону шестой степени» Дерягина:
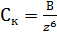 %,
%,
где 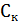 - порог коагуляции, z- валентность сшивающего катиона, В-константа коагуляции.
- порог коагуляции, z- валентность сшивающего катиона, В-константа коагуляции.
Период коагуляции сшивания частиц зависит от дисперсности и разновидности глинистых частиц породы, вязкости и температуры бурового раствора.
Как известно, почти все химические процессы (в том числе и процессы коагуляции) являются двусторонними, обратимыми. В начале, они идут в одном направлении (например, «сшивание» частиц) затем в обратном направлении (разрушение связи) в результате взаимодействия продуктов реакции с побочными продуктами (например, взаимодействия глинистых частиц с выделившейся в процессе коагуляции водой).
Необратимость процесса коагуляции возможна только тогда, когда побочные продукты взаимодействия (в частности вода) удаляются из сферы реакции (например, за счет «отсасывания» воды из глины раствором электролитов) или когда вследствие высокой концентрации электролитов обратный процесс подавляется.
Но при обратимых процессах при соответствующих условиях устанавливается равновесие. Равновесным состоянием называют некое состояние системы, которое при постоянных внешних условиях не изменяется во времени.
Различают устойчивые и неустойчивое равновесие. «Устойчивым равновесием является динамическое постоянство свойств системы, обусловленное одинаковой скоростью прямого и обратного процессов длительное время». Неустойчивое равновесие это кратковременное равновесие при обратимых процессах в момент перехода от прямого к обратимому процессу.
Неустойчивое равновесие обусловлено недостатком взаимодействующих реагентов.
Рассмотрим более конкретно происходящие процессы взаимодействия полимерполисолевых растворов с глинистой породой.
Для ограничения насыщения глины водой в раствор вводят ингибиторы гидратации- соли одновалентных металлов, для предотвращения диспергирования- полимеры. Но главную роль для повышения крепящих свойств раствора выполняют катионы солей поливалентных металлов.
Под воздействием отрицательного заряда глинистых частиц катионы «всасываются» породой, нейтрализуют заряд и сшивают глинистые частицы между собой.
«Всасывание» поливалентных глинофильных катионов глинистыми частицами будет происходить до тех пор пока не установится равенство обьемных энергий глины и раствора, то есть равенство зарядов глинистых частиц плюс зарядов катионов, внедренных в глину и зарядов катионов и анионов раствора. Концентрация электролитов при которой происходит полная коагуляция (сшивание) частиц также носит название равновесной.
При полной коагуляции заряд глинистых частиц нейтрализуется и выделившаяся вода (побочный продукт реакции) «всасывается» раствором электролитов. В объем глины вода из зоны реакции перемещаться не может поскольку там заряд глинистых частиц нейтрализован одновалентными катионами (электролитов-ингибиторов коагуляции).
При «сшивании» частиц плотность и прочность модифицированного слоя глины резко возрастают и могут достигать плотности и прочности скальной породы. Плотный модифицированный слой глины кроме того дополнително предотвращает массоперенос воды и ионов.
При недостаточной концентрации солей поливалентных металлов также за счет полимеров предотвращается диспергирование глины в объеме и снижение ее влажности, но вследствие недостатка ионы поливалентных металлов только частично связывают глинистые частицы и незначительно повышают прочность глины. После всасывания глиной катионов в растворе остаются только анионы, что ведет к дисбалансу объемных энергий глины и раствора. Вследствие этого наблюдается обратный процесс. Под воздействием анионов раствора катионы из глины возвращаются в раствор, а на их замену в глину из раствора- молекулы воды, что постепенно разупрочняет и разрушают глинистую породу. Вследствие отстутсвия плотного модифицированного органоминерального слоя происходит по-прежнему взаимный обмен катионов и молекул воды. При высокой концентрации поливалентных солей в начале также происходит «сшивание» глинистых частиц и упрочнение глины. Но и после насыщения глины катионами наблюдается дисбаланс объемных энергий глины и раствора. Концентрация поливалентых катионов в растворе отсается высокой, благодоря чему происходит сначала коагуляция полимеров, а затем диспергирование глины. Глинистые частицы, попадая в раствор с высокой концентрацией поливалентых глинофильных катионов коагулируют и выпадают в осадок. Для определения равновесной концентрации электролитов можно использовать «закон шестой степени», а константу коагуляции равновесия для конкретного типа глин определить экспериментальным путем. Для используемой при экпериментальных исследованиях образцов глины из черногорского глинопорошка она оказалась равной 70%. В этом случае равновесная концентрация ионов солей одновалентных катионов будет будет:
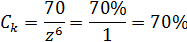
Для солей NaCl, в котором ионы 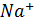 составляют
составляют
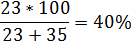
равновесная концентрация будет:
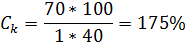
Для солей KCl она соответсвенно будет:
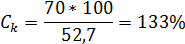
Растворимость соли NaCl равное при 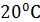 - 26,4%, соли KCl-25,5%, то есть даже при полном насыщении раствора солями одновалентных металлов равновесную концентрацию ионов невозможно, и с помощью этих электролитов нельзя существенно скоагулировать и модифицировать глинистую породу.
- 26,4%, соли KCl-25,5%, то есть даже при полном насыщении раствора солями одновалентных металлов равновесную концентрацию ионов невозможно, и с помощью этих электролитов нельзя существенно скоагулировать и модифицировать глинистую породу.
Равновесная концентрация катионов солей двухвалентных металлов равна:

бишофита MgCl*6 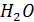 , содержащего
, содержащего 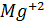

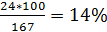
хлористого кальция Ca 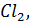 содержащего катионов
содержащего катионов 


Равновесная концентрация катионов солей трехвалентных металлов будет равна:

Соли 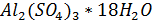 , содержащей катионов
, содержащей катионов 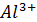
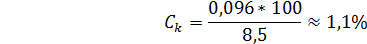

Концентрация в области полной коагуляции может несколько отличаться от равновесной.
Следует отметить, что при определении равновесной концентрации электролитов следует учитывать наличие и состав обменных катионов горной породы. При большой концентрации катионов  в глине концентрацию вводимых солей поливалентных материалов следуеь снизить.
в глине концентрацию вводимых солей поливалентных материалов следуеь снизить.
Большинство ионов в растворе прочно связываются с окружающими их молеклами воды образуя гидратные компдексы 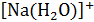 ,
, 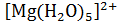 ,
, 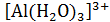 и.т.д. Вода в гидратах отличается от обменной большей плотностью и вязкостью, пониженной температурой замерзания.
и.т.д. Вода в гидратах отличается от обменной большей плотностью и вязкостью, пониженной температурой замерзания.
Молекулы (диполи) воды вокруг катионов своим отрицательным полюсом повернуты в сторону катионов, а положительным в обратную сторону и гидратированный катион сохраняет положительный заряд. Молекулы воды вокург анионов повернуты своим положительным полюсом в сторону аниона, а отрицательным в обратную и гидратный комплекс также оказывается с отрицательным зарядом.
При взаимодействии гидратных комплексов анионов и катионов образуются кристаллогидраты. Прочная связь между ионами и молекулами воды сохраняется и в кристаллогидратах. Анализ таких кристаллогидратов показывает, что в них содержатся указанные выше нидратные комплексы анионов и катионов.
Наличие в растворе гидратов также как и в глинистых растворах понижает температуру замерзания раствора.
Количество гидратированных молекул воды в гилратах и кристаллогидратах зависит от концентрации электролитов и количества воды в растворе.
Для примера рассмотрим процесс изменения структуры раствора серной кислоты.
При постепенном разбавлении серной кислоты водой до 25% воды происходит диссоциация молекул 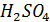 , на что затрачивается энергия, и температура замерзания снижается -40
, на что затрачивается энергия, и температура замерзания снижается -40 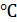 . При увеличении количества воды в растворе с 25 до 40% происходит постепенная гидратация молекул
. При увеличении количества воды в растворе с 25 до 40% происходит постепенная гидратация молекул 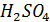 и при 40% воды появляются в растворе гидраты
и при 40% воды появляются в растворе гидраты 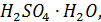 а температура замерзания при диссоциации этого раствора понижается до -60
а температура замерзания при диссоциации этого раствора понижается до -60 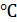 и т.д.
и т.д.
При бурении скважин в мерзлых породах где требуются растворы с низкой температурой замерзания применяют солевые или полимерсолевые растворы, в которых используют электролит NaCl раствора с гидрофобным катионом 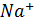 , способным понижать температуру раствора. При введении в раствор NaCl на каждые 15-17 кг/
, способным понижать температуру раствора. При введении в раствор NaCl на каждые 15-17 кг/ 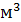 температура замерзания раствора понижается на 1
температура замерзания раствора понижается на 1 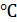 .
.
Далее при большой концентрации электролита с гидрофильными ионами из раствора выпадают кристаллогидраты с увеличением концентрации соли температура замерзания понижается, а количество кристаллогидратов увеличивается, повышается количество связанной воды.
Дата публикования: 2014-11-03; Прочитано: 639 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
