 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Термодинамика
|
|
К середине 19 в. возрастает потребность в теории действия паровой машины. В 1849 г. Вильям Томсон (1824-1907, впоследствии лорд Кельвин) занялся расчетами мощности паровой машины. Он еще опирается на теорию теплорода. В 1850 г. Рудольф Клаузиус (1822-1888) пересматривает представления о работе тепловой машины. Он ввел понятие внутренней энергии. Клаузиусу пришлось защищать принцип Карно, который впоследствии лег в основу т.н. второго начала термодинамики (теплота не может самопроизвольно переходить от холодного конца к теплому). По Клаузиусу, явления природы необратимы. В 1865 г. Клаузиус ввел новую величину - энтропию, вернее ее изменение.
В идеальном случае обратимых процессов энтропия остается постоянной. Этимологически “энтропия” означает “изменение”. Сопротивление ученых введению этого понятия связано с тем, что энтропия не действует на наши органы чувств. Но физика продолжала терять наглядность. Окончательные права гражданства механическая теория теплоты приобрела в науке лишь к концу 19 в. благодаря работам Больцмана и Макса Планка (1887-1892).
Основоположники термодинамики Карно, Майер, Джоуль в сущности не интересовались природой теплоты, но лишь переходом ее в работу. В 1851г. В. Томсон (он же лорд Кельвин) формулирует 2-е начало термодинамики: “Невозможно при помощи неодушевленного материального деятеля получить от какого-либо количества вещества механическую работу путем охлаждения ее ниже температуры самого холодного из окружающих предметов”. Томсон считает эту формулировку отличающейся только по форме от положения Клаузиуса, которому, по Томсону, и принадлежит приоритет, хотя он, Томсон, и пришел к своей формулировке самостоятельно. Томсон определил КПД 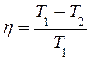 тепловой машины. Он же установил и абсолютную температурную шкалу (шкала Кельвина).
тепловой машины. Он же установил и абсолютную температурную шкалу (шкала Кельвина).
В 1854 г. в своей статье Томсон идет дальше: если система совершает обратимый цикл и получает или отдает при этом количества теплоты 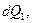
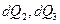

 ...
... 
 - при соответствующих температурах
- при соответствующих температурах 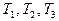 (в современных обозначениях), то для
(в современных обозначениях), то для  всего цикла имеет место равенство:
всего цикла имеет место равенство: 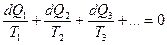 .
.
В. Томсон считал это математической формулировкой 2-го закона динамической теории теплоты (термодинамики). Клаузиус обобщил это как 
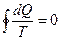 . Таким образом,
. Таким образом,  - полный дифференциал для обратимых процессов и является термодинамической функцией (Ранкин). Если принять обозначения
- полный дифференциал для обратимых процессов и является термодинамической функцией (Ранкин). Если принять обозначения 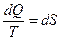 или, в общем случае
или, в общем случае 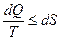 , то появляется функция
, то появляется функция 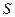 , которую Клаузиус считал мерой способности теплоты к превращению и дал название “энтропия”.
, которую Клаузиус считал мерой способности теплоты к превращению и дал название “энтропия”.
Новый закон утверждал односторонность протекания всех физических процессов. В результате энергия “обесценивается”, “деградирует”, в замкнутой системе наступает “тепловая смерть”. Возникает противоречие между 1-ым и 2-ым началами: энергия сохраняется лишь формально, но деградирует. Тепловая смерть Вселенной как бы становится оправданием библейской легенды о сотворении и конце мира.
Важный вклад в атомистическое обоснование термодинамики внес Максвелл в книге “Пояснение к динамической теории газов” (1860). Он выводит закон распределения частиц по скоростям. Наиболее важные результаты по развитию кинетической теории теплоты были получены Людвигом Больцманом (1844-1906). В 1866 г. он дает усовершенствованное доказательство закона распределения молекул по скоростям, вывел кинетическое уравнение (1872).
В том же 1872 г. Больцман впервые доказал знаменитую Н-теорему (название было дано позже), согласно которой идеальный газ, находящийся первоначально в нестационарном состоянии и рассматриваемый с точки зрения молекулярно-кинетической теории, сам собой с течением времени должен переходить в состояние статистического равновесия, а функция распределения переходит к функции Максвелла-Больцмана.
Против атомистики в 1895 г. резко выступил Оствальд, затем Мах. Атомизм казался пройденным этапом. Однако, в начале 20 в. отношение к теории Больцмана изменилось. Нужно отметить, что Больцман опирался на понятие энтропии, которую он толковал вероятностным образом. Теория Больцмана получила признание вместе с исследованием броуновского движения (1827 г. - биолог Р.Броун).
Сначала считали, что причина - в органическом происхождении броуновских частиц, затем поняли, что это не так, и стали объяснять конвекционными потоками в жидкости. Затем - тепловым движением атомов и молекул. В 1905 г. Эйнштейн рассмотрел броуновское движение как подтверждение кинетической теории теплоты и атомной гипотезы, считая броуновскую частицу аналогом молекулы.
Метод исследования, примененный Больцманом и Максвеллом и названный затем Максвеллом статистическим, был развит далее Гиббсом в 1902 г. Гиббс использовал представления о фазовом пространстве.
Для объяснения отсутствия “тепловой смерти” Больцман выдвинул флуктуационную гипотезу, в которой впервые опровергалась возможность применения 2-го закона ко всей Вселенной. Обсуждение этого вопроса растянулось на целое столетие, а само значение 2-го закона термодинамики не уменьшилось, а возросло, поскольку теперь его связывают с понятием информации.
Интересен мысленный эксперимент, который предложил Максвелл.[21] Это эксперимент с “демоном”, который перегоняет все молекулы через задвижку из одной половины сосуда в другую, и тогда второе начало будет нарушено. Большинство физиков, например Пуанкаре, не хотело мириться с вероятностным подходом, и стояло на позициях изначального детерминизма.
В первой половине 20-го века возникла термодинамика необратимых процессов, рассмотревшая процессы перехода к равновесию в неравновесных системах. Теорема американского физика Онсагера (1931 г., Нобелевская премия по физике, 1968 г.) связывает т.н. потоки (массы, энергии, энтропии) с термодинамическими силами (вспомним Р. Майера!)..
На основе работ Л. Онсагера (1903-1976) бельгийский физик и химик И.Р. Пригожин рассмотрел условия минимального производства энтропии в неравновесных условиях. Эти работы заложили основы термодинамики открытых систем. Применение этих положений ко всей Вселенной позволяет по-новому взглянуть на проблему "тепловой смерти", которая теперь перестала считаться неизбежным результатом эволюции, в противоположность выводу Р. Клаузиуса (1865г.), сделанному на основе равновесной термодинамики (2-ое начало).
Дата публикования: 2014-11-02; Прочитано: 683 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
