 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Идеальный газ
|
|
Простая гомогенная система в равновесном состоянии характеризуется определенными значениями параметров состояния v, P и Т. Уравнение, устанавливающее связь между давлением, температурой и удельным объемом системы, называется термическим уравнением состояния и имеет вид
F (R, v, T) = 0. (1.5)
Состояние системы вполне определяется заданием двух из указанных параметров, т.к. любой из трех параметров является для каждого равновесного состояния однозначной функцией двух заданных. Поэтому можно записать, что
P = f 1(v, T); v = f 2(R, T); T = f 3(v, P).
Термическое уравнение состояния газов при малых давлениях принимает простое выражение. Если по измеренным значения R, v и Т рассчитать величину P × v / T, то получим
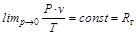 . (1.6)
. (1.6)
Константа R г называется газовой постоянной и имеет для каждого газа свое значение. Она представляет собой работу 1 кг газа при постоянном давлении и при изменении температуры на 1 градус. Используя понятие газовой постоянной, уравнение состояния можно записать в виде
Pv = R г T. (1.7)
Газ, состояние которого точно описывается уравнением (1.7), называется идеальным, а само уравнение - термическим уравнением состояния идеальных газов, или уравнением Клапейрона.
Для m кг идеального газа уравнение состояния имеет вид
PV = mR г T, (1.8)
где V - объем газа, м3.
Умножая обе части уравнения (1.8) на молекулярную массу m, получим
PV m = m R г T, (1.9)
где V m = v ×m - объем, занимаемый одним молем газа.
Молем или киломолем называется количество газа, масса которого в килограммах численно равна его молекулярной массе.
Произведение m R г = R называется универсальной газовой постоянной. Ее значение при нормальных условиях для 1 кмоль любого газа равно 8314,41 Дж/(кмоль×К).
Каждый идеальный газ характеризуется также удельной теплоемкостью. Теплоемкостью называется количество теплоты, которое нужно подвести к газу или отнять от него для изменения температуры газа на 1 °С. Под удельной теплоемкостью газа понимают отношение теплоты, полученной единицей количества вещества при бесконечно малом изменении его состояния, к изменению температуры.
Теплоемкость является функцией процесса и не входит в число термодинамических параметров.
Различают массовую и объемную теплоемкости.
Теплоемкость, отнесенную к 1 кг газа, называют удельной массовой и обозначают с, Дж/кг×К.
Теплоемкость, отнесенную к 1 м3 газа при нормальных физических условиях называют удельной объемной и обозначают с ', Дж/м3×К.
Между указанными удельными теплоемкостями существует зависимость
с = c ' v 0,
где V 0 - удельный объем газа при нормальных условиях.
Теплоемкость, отнесенную к 1 кмоль газа, называют удельной мольной и обозначают с m = m× с, кДж/(кмоль×К).
Теплоемкость зависит от характера процесса. В термодинамике большое значение имеют удельная теплоемкость при постоянном объеме cv (изохорная теплоемкость), равная отношению количества теплоты к изменению температуры газа в процессе при постоянном объеме, и удельная теплоемкость при постоянном давлении ср (изобарная теплоемкость), равная отношению количества теплоты к изменению температуры газа в процессе при постоянном давлении.
Для идеального газа связь между изобарной и изохорной теплоемкостями определяется уравнением Майера
ср - cv = R г,
или
m ср - m сv = R = 8314,41, Дж/(кмоль×К).
Удельные теплоемкости идеальных газов ср и сv в общем случае представляют собой сложные функции температуры, поэтому в расчетах используют средние значения удельных теплоемкостей, обычно заданные в табличной форме для определенных значений температур. Средней удельной теплоемкостью данного процесса в интервале температур от t 1 до t 2 называют отношение количества теплоты, переданного в процессе, к конечной разности температур t 1 - t 2. Методика определения средних значений ср и сv и примеры расчета приведены в [2].
Из первого закона термодинамики следует, что теплота, подведенная к рабочему телу, затрачивается на изменение внутренней энергии и на совершение работы.
Внутренняя энергия - это энергия, заключенная в системе. Она состоит из кинетической энергии, вращательного и колебательного движения молекул, потенциальной энергии взаимодействия молекул, энергии внутриатомных и внутриядерных движений частиц и др.
Внутренняя энергия является однозначной функцией внутренних параметров состояния (температуры, давления) и состава системы.
Для упрощения расчетов термодинамических процессов У. Гиббсом введена функция J для m кг массы, называемая энтальпией и i для 1 кг массы, называемая удельной энтальпией.
Энтальпия J относится к экстенсивным параметрам, т.к. ее величина пропорциональна массе.
Удельная энтальпия i представляет собой сложную функцию и может быть выражена формулой
i = u + Pv,
где u - удельная внутренняя энергия газа.
Поскольку входящие в формулу величины u, P и v являются параметрами состояния, то и сама удельная энтальпия также будет параметром состояния.
Физический смысл энтальпии состоит в том, что в изобарных процессах изменение энтальпии равно количеству теплоты, поглощенной или отданной системой.
Удельная энтальпия идеального газа, также как и внутренняя энергия, является функцией только температуры и не зависит от объема и давления.
В термодинамике не требуется знание абсолютного значения энтальпии, поэтому ее отсчитывают от некоторого условного нуля. Для идеального газа принято считать энтальпию равной нулю при температуре t 0 = 0 °С.
Приращение энтальпии для любого процесса изменения состояния идеального газа в пределах одной фазы (газообразной, жидкой или твердой) определяется по формуле
D i 1-2 = i 2 – i 1 = 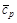 (T 2 – T 1).
(T 2 – T 1).
Если считать, что it = 0= 0, то энтальпия газа при температуре t
i = 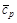 × t, кДж/кг. (1.10)
× t, кДж/кг. (1.10)
Формула (1.10) показывает, что удельная энтальпия идеального газа численно равна количеству теплоты, которая подведена к 1 кг газа при нагревании его от 0 °С до температуры t °C при постоянном давлении.
Дата публикования: 2014-11-02; Прочитано: 707 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
