 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Тема 6. Гигиеническая оценка качества питьевой воды
|
|
Цель занятия:
1. Ознакомление с гигиеническими требованиями и нормативами качества питьевой воды.
2. Оценка качества образца питьевой воды посредством определения органолептических, химических показателей, а также содержания растворенного кислорода.
3. Оформление гигиенического заключения по оценке качества питьевой воды с рекомендациями по улучшению ее качества.
Место проведения занятия: учебно-профильная лаборатория гигиены воды.
Согласно санитарным правилам и нормам «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества» (СанПиН 2.1.4.1074-01), введенным с 26 сентября 2001 г., питьевая вода должна быть безопасна в эпидемическом и радиационном отношении, безвредна по химическому составу и иметь благоприятные органолептические свойства.
Безопасность воды в эпидемическом отношении подтверждается определением общего микробного числа (не более 50 образующих колонии бактерий в 1 мл), термотолерантных колиформных бактерий, общих колиформных бактерий, колифагов, спор клостридий и цист лямблий. В случае превышения нормативов проводится исследование воды на наличие патогенных бактерий кишечной группы и энтеровирусов.
Безвредность питьевой воды по химическому составу определяется ее соответствием нормативам по обобщенным показателям и содержанию вредных химических веществ.
Таблица 23
Химические показатели качества питьевой воды
| Показатели | Единицы измерения | Нормативы (ПДК), не более | Класс опасности |
| Водородный показатель | единицы pH | в пределах 6–9 | |
| Общая минерализация (сухой остаток) | мг/л | 1000 (1500) | |
| Жесткость общая | ммоль/л | 7,0 (10) | |
| Окисляемость перманганатная | мг/л | 5,0 | |
| Нефтепродукты | мг/л | 0,1 | |
| Поверхностно-активные вещества (ПАВ) | мг/л | 0,5 | |
| Нитраты | мг/л | ||
| Сульфаты | мг/л | ||
| Хлориды | мг/л | ||
| Ртуть | мг/л | 0,0005 | |
| Свинец | мг/л | 0,03 | |
| Мышьяк | мг/л | 0,05 | |
| Марганец | мг/л | 0,1 (0,5) | |
| Хлор –остаточный свободный –остаточный связанный | мг/л мг/л | в пределах 0,3–0,5 в пределах 0,8–1,2 | |
| Хлороформ | мг/л | 0,2 | |
| Озон остаточный | мг/л | 0,3 | |
| Формальдегид | мг/л | 0,05 |
Примечание: величина, указанная в скобках, может быть установлена для конкретной системы водоснабжения на основании оценки санитарно-эпидемиологической обстановки.
Жесткость обусловлена солями кальция и магния. Устранимая жесткость связана с бикарбонатами кальция и магния, которые при кипячении превращаются в плохо растворимые монокарбонаты, выпадающие в осадок. Неустранимая жесткость зависит от содержания хлоридов, сульфатов и прочих солей кальция и магния. Вода с высокой жесткостью приводит к чрезмерному потреблению мыла и последующему образованию «пены». При нагревании жесткая воды образует отложения накипи. Мягкая вода в большей степени вызывает коррозию водопроводных труб.
При большой концентрации солей кальция в питьевой воде, превышающей концентрацию солей магния, увеличивается частота болезней системы кровообращения, пищеварительной, мочеполовой и костно-мышечной систем, растет заболеваемость всеми формами рака. Согласно другим данным, среди населения, употребляющего маломинерализованную воду, более, чем у тех, кто пьет воду с нормальным количеством минеральных солей, распространены заболевания сердечно-сосудистой, эндокринной, пищеварительной и мочеполовой систем. Физическое развитие детей лучше в районах, снабжаемых водой с оптимальным содержанием солей. У женщин, потребляющих маломинерализованную воду, чаще встречаются ранние и поздние токсикозы. Новорожденные из районов, где вода была с низкими показателями жесткости, имели более низкий уровень здоровья.
Одним из условных химических показателей загрязнения воды является окисляемость, выражаемая в миллиграммах кислорода, расходуемого на окисление органических веществ, содержащихся в 1 л воды. Если окисляемость превышает 5 мг/л, то это указывает на возможное загрязнение водоисточника.
Аммиак в окружающей среде появляется как продукт процессов метаболизма сельскохозяйственного и промышленного производства, а также в результате процесса обеззараживания с использованием хлорамина. Аммиак в воде является индикатором возможного бактериального загрязнения, присутствия сточных вод и отходов животноводства. Исключение составляет аммиак растительного или геохимического происхождения. Обнаружение в воде аммиака обычно свидетельствует о ее свежем загрязнении. Дальнейшим продуктом окисления аммонийных солей являются нитриты. Нитраты представляют собой конечный продукт окисления. Наличие их в воде при отсутствии аммиака и нитритов свидетельствует о сравнительно давнем попадании в воду азотсодержащих веществ. В организме нитраты восстанавливаются в нитриты и вызывают метгемоглобинемию. Наиболее подверженными метгемоглобинемии считаются младенцы в возрасте до трех месяцев, однако такая патология встречается и у взрослого населения.
Эксперименты показывают, что ни нитраты, ни нитриты не действуют непосредственно как канцерогены, но существует беспокойство по поводу повышения риска рака для человека в результате образования N-нитрозосоединений, многие из которых являются канцерогенами.
Хлориды являются показателем бытового загрязнения. Повышение концентрации хлоридов в воде говорит об опасном загрязнении воды продуктами жизнедеятельности человека (фекалии, моча). Они могут быть в местах с солончаковой почвой, и в этом случае они не указывают на загрязнение воды. Кроме того, установлена прямая связь между уровнем хлоридов в воде и заболеваниями органов кровообращения. При высокой концентрации хлоридов наблюдается повышение артериального давления у взрослых и детей.
Сульфаты являются показателем загрязнения воды животными отбросами. При большом количестве их в воде ингибируется всасывание воды и нарушается желудочная секреция, т.е. отмечается послабляющее действие.
Благоприятные органолептические свойства воды определяются ее соответствием нормативам, указанным в таблице 24, а также нормативам содержания веществ, оказывающих влияние на органолептические свойства воды, приведенным в таблице 23.
Таблица 24
Органолептические показатели качества питьевой воды
| Показатели | Единицы измерения | Нормативы, не более |
| Запах | баллы | |
| Привкус | баллы | |
| Цветность | градусы | 20 (35) |
| Мутность | мг/л | 1,5 (2) |
Привкус и запах воды связаны с естественными источниками или процессами (например, водными микроорганизмами), с химическим загрязнением или с очисткой и обеззараживанием воды. Привкус и запах могут также возникать при хранении и распределении воды. Привкус и запах не должны вызывать неприятных ощущений у потребителя.
Цветность питьевой воды обычно обусловлена присутствием окрашенного органического вещества, связанного с почвой. На цветность сильно влияет присутствие железа и других металлов в виде естественных примесей или в качестве продукта коррозии. Она бывает также обусловлена загрязнением водоисточника промышленными стоками.
Мутность питьевой воды обусловлена взвешенными веществами, которые могут присутствовать в воде вследствие недостаточной очистки. Мутность может также объясняться присутствием взвешенных неорганических веществ в некоторых грунтовых водах. Сильная мутность защищает микроорганизмы при обеззараживании и стимулирует рост бактерий.
Растворенный кислород является показателем способности воды к самоочищению. Он необходим для развития сапрофитных аэробных бактерий, с жизнедеятельностью которых связаны окислительные процессы в воде. Норматив содержания растворенного кислорода в теплый период года составляет 7–9 мг/л, в холодный – 10–15 мг/л. Повышению этого показателя способствует процесс фотосинтеза, уменьшению – загрязнение открытых водоемов. Недопустимым считается уменьшение содержания растворенного кислорода ниже 4 мг/л. Исключение составляют подземные воды, не содержащие кислорода, что не указывает на их загрязненность.
ПОРЯДОК ВЫПОЛНЕНИЯ ИССЛЕДОВАНИЙ
1. Определение запаха. В колбу на 200 мл наливают 100–150 мл исследуемой воды, закрывают, встряхивают и, открыв, сразу же оценивают интенсивность ощущения при комнатной температуре по 5-бальной шкале. Характер запаха указывают описательно, например, "болотный", "гнилостный", "рыбный" и т.д.
2. Определение цветности. Интенсивность окрашивания исследуемой воды сравнивают с интенсивностью окрашивания стандартных растворов шкалы Рублевской водопроводной станции. Для этого в пустую пробирку наливают количество воды, равное стандартному, и сравнивают с образцами. Найдя наиболее близкий к исследуемой воде образец, оценивают ее цветность в градусах.
3. Определение общей жесткости. Жесткость определяют комплекснометрическим методом с трилоном Б в присутствии индикатора хромогена синего. В воде ионы кальция и магния образуют с хромогеном синим непрочные яркокрасные соединения. При титровании таких растворов трилоном Б происходит изменение окраски в синий цвет в точке эквивалентности, т.е. когда добавленное количество трилона Б свяжет ионы кальция и магния в бесцветные комплексы (окраска зависит от освобожденного индикатора хромогена синего). Эта реакция идет в щелочной среде (pH > 9).
Для определения общей жесткости в колбу наливают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора и стеклянную ложечку хромогена синего. Затем титруют 0,1 н раствором трилона Б до появления синего окрашивания (с учетом постепенного процесса комплексообразования раствор трилона Б необходимо приливать медленно, в конце титрования только по каплям с интервалом в 5–10 сек.). Умножая количество мл 0,1 н раствора трилона Б, пошедшего на титрование, на поправочный коэффициент этого раствора (К), получают общую жесткость в мг-экв/л.
4. Определение окисляемости. Метод основан на окислении органических веществ воды раствором марганцевокислого калия в кислой среде при нагревании. Остаток взятого с избытком окислителя связывают точным раствором щавелевой кислоты, непрореагировавшее количество которой дотитровывают тем же раствором KMnO4. Титр последнего определяют по 0,01 н раствору щавелевой кислоты, 1 мл которого эквивалентен 0,08 мг кислорода.
MnO4- + 8H+ + 5e = Mn++ + 4H2O;
2MnO4- + 5C2O4-- + 16H+ = 2Mn++ + 10CO2 + 8H2O.
В колбу к 100 мл исследуемой воды приливают 5 мл серной кислоты 1:3 и 10 мл 0,01 н раствора KMnO4. Ее нагревают до кипячения и, начиная с этого момента, кипятят в течение 10 минут. Затем в горячую колбу добавляют 10 мл 0,01 н раствора щавелевой кислоты, перемешивают содержимое колбы покачиванием и обесцвеченный раствор титруют 0,01 н раствором KMnO4 до слабо розового окрашивания. Для определения титра KMnO4 в тот же раствор, пока он не остыл, добавляют 10 мл 0,01 н раствора щавелевой кислоты и вновь титруют 0,01 н раствором KMnO4.
Окисляемость расcчитывают по следующей формуле:
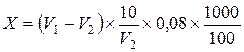 , где
, где
X – окисляемость воды, мг/л;
V 1 – суммарное количество 0,01 н раствора KMnO4, добавленное перед кипячением и пошедшее на первое титрование;
V 2 – количество 0,01 н раствора KMnO4, пошедшее на второе титрование;
(V 1 – V 2) – количество раствора KMnO4, идущее на окисление взятой пробы воды;
10 – титруемый объем щавелевой кислоты при определении титра KMnO4;
умножение на  – перерасчет на точно 0,01 н раствор KMnO4;
– перерасчет на точно 0,01 н раствор KMnO4;
0,08 – количество кислорода, эквивалентное 1 мл 0,01 н раствора KMnO4;
умножение на 0,08 – переход с количества мл 0,01 н раствора KMnO4 на кислород;
 – перерасчет с объема взятой пробы на 1 литр.
– перерасчет с объема взятой пробы на 1 литр.
5. Определение солевого аммиака. Метод основан на образовании с реактивом Несслера иодистого меркураммония, придающего воде желтое окрашивание различной интенсивности в зависимости от содержания аммиака.
К 50 мл исследуемой воды прибавляют 2 капли сегнетовой соли и 1 мл реактива Несслера, все перемешивают. Через 5 минут полученный цветной раствор калориметрируют с помощью ФЭКа, пользуясь прямо пропорциональной зависимостью между оптической плотностью окрашенного раствора и концентрацией солевого аммиака.
При проведении колориметрирования на пути левого и правого пучков помещают кюветы с дистиллированной водой. Индекс правого барабана устанавливают на нулевом делении шкалы оптической плотности (красного цвета). Включают гальванометр, устанавливают его стрелку на нуль вращением фотометрического клина на пути левого пучка (рукояткой грубой настройки и тонкой настройки). Это делается при нахождении переключателя чувствительности гальванометра на первом, а затем на втором положении. Потом в правый световой пучок помещают кювету с исследуемым раствором, стрелка гальванометра отклонится, так как на правый фотоэлемент будет падать уменьшенный поток света. Вращением правого барабана увеличивают ширину щелевой диафрагмы до установления стрелки гальванометра снова на нуль. Величину оптической плотности определяют по правому барабану (красная шкала) и находят количественное содержание солевого аммиака по калибровочному графику.
6. Определение нитратов. Метод основан на переводе салициловой кислотой азота нитратов в нитропроизводные фенола, образующие в щелочной среде соединения, окрашенные в желтый цвет.
В фарфоровой чашке выпаривают досуха 1 мл исследуемой воды, не допуская прокаливания. После охлаждения к сухому остатку добавляют 3 капли раствора салициловой кислоты и 10 капель концентрированной серной кислоты. Сухой остаток тщательно растирают с реактивами стеклянной палочкой. После 5-ти минутного стояния в чашку прибавляют 5 мл дистиллированной воды и 3 мл раствора едкого натра. Ее содержимое хорошо перемешивают, затем переливают в пробирку с меткой на уровне 10 мл, доливают до метки дистиллированной водой. Затем часть полученного раствора переливают в другую калориметрическую пробирку до метки на уровне 5 мл. Полученную в последней пробирке окраску сравнивают с эталонами жидкой шкалы, рассматривая растворы сверху. Концентрация нитратов в исследуемой воде соответствует концентрации, указанной на том эталоне, с которым совпадает интенсивность окрашивания.
7. Определение содержания растворенного кислорода. При наличии в воде растворенного кислорода после внесения туда хлористого марганца и едкого натра образуется гидрат окиси марганца, причем количество последнего будет эквивалентно количеству кислорода в воде.
2MnCl2 + 4NaOH = 2Mn(OH)2 + NaCl;
4Mn(OH)2 + O2 + 2H2O = 4Mn(OH)3.
Гидрат окиси марганца с соляной кислотой образуют хлорный марганец, распадающийся на хлористый марганец и хлор:
2Mn(OH)3 + 6 HCl = 2MnCl3 + 6H2O;
2MnCl3 = 2MnCl2 + Cl2.
Хлор выделяет из иодистого калия иод в количестве, эквивалентном поглощенному из воды кислороду, а иод титруют с 0,01 н раствором гипосульфита натрия.
Cl2 + 2KI = 2KCl + I2 ;
I2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Исследуемая вода находится во флаконе с притертой пробкой, чтобы избежать соприкосновения жидкости с атмосферным воздухом. На дно пробы вносят пипеткой 1 мл раствора хлористого марганца и 1 мл щелочной смеси (раствор едкого натра с иодистым калием). После этого флакон сразу же закрывают пробкой, в связи с чем через край горлышка выливается 2 мл содержимого флакона, несколько раз переворачивают, размешивая образовавшиеся хлопья, и оставляют стоять несколько минут.
Вслед за образованием осадка на дно пробы приливают 2 мл концентрированного раствора соляной кислоты, закрывают флакон пробкой, несколько раз переворачивают, переливают его содержимое в колбу, добавляют туда 0,5–1 мл крахмала и титруют 0,01 н раствором гипосульфита натрия до обесцвечивания. Содержание растворенного кислорода в воде рассчитывают по следующей формуле:
 , где
, где
X – содержание растворенного кислорода в воде, мг/л;
0,08 – количество кислорода, эквивалентное 1 мл 0,01 н раствора гипосульфита натрия;
А – количество мл 0,01 н раствора гипосульфита натрия, пошедшее на титрование;
К – поправочный коэффициент 0,01 н раствора гипосульфита натрия;
V – объем флакона, мл;
V 1– объем прилитых реактивов (NaOH + KI + MnCl2) для образования осадка (2 мл);
1000 – пересчет на 1 литр.
Сводные данные проведенных исследований
Таблица 25
Показатели качества воды
| Показатели качества исследуемой воды | Полученные данные | Нормативы |
| Запах, баллы | не более 2 | |
| Характер запаха (описательно) | ||
| Цветность, градусы | не более 20 | |
| Общая жесткость, ммоль/л | не более 7 | |
| Окисляемость, мг/л | не более 5 | |
| Солевой аммиак, мг/л | не более 0,1 | |
| Нитраты, мг/л | не более 45 | |
| Содержание растворенного кислорода, мг/л | не ниже 4 |
Гигиеническое заключение. Дается обоснованная оценка качества исследуемой воды по ее органолептическим свойствам, жесткости, окисляемости, содержанию солевого аммиака и нитратов. Отмечается также способность данной воды к самоочищению.
Контрольные вопросы.
1. Группы показателей, характеризующих качество питьевой воды.
2. Гигиеническая характеристика органолептических показателей качества воды и методы их определения.
3. Гигиеническое значение жесткости питьевой воды и метод ее определения.
4. Гигиеническое значение загрязнения воды органическими соединениями.
5. Химические показатели, характеризующие загрязнение воды, и методы их определения.
6. Сущность биохимических процессов превращения азотсодержащих веществ в воде.
7. Токсиколого-гигиеническая оценка нитратов в воде.
8. Гигиеническое значение содержания растворенного кислорода в воде, принцип метода его определения.
9. Эпидемические показатели качества питьевой воды.
Дата публикования: 2014-11-02; Прочитано: 3869 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
