 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример выполнения задания
|
|
Галлий располагается в IV периоде (следовательно, у него 4 энергетических уровня), III группе (следовательно, сумма валентных электронов равна 3) главной подгруппе (следовательно, валентными являются s- и p-электроны внешнего энергетического уровня; на внешнем энергетическом уровне находится 3 электрона):
 – распределение электронов по энергетическим уровням
– распределение электронов по энергетическим уровням
Электронная формула: 1s2 2s22p6 3s23p6 4s2 3d10 4p1 (табл. 4, с. 16)
валентные электроны: 4s24p1 – это р-элемент.
Электронно-графическая формула галлия:
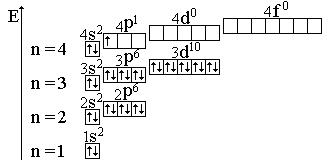
Е – энергия, следовательно, приведенная схема является не только электронно-графической формулой, но и энергетической диаграммой;
n – главное квантовое число, которое совпадает с номером энергетического уровня
Определяем валентные возможности галия, для этого распишем валентные электроны атома по орбиталям в нормальном (н. с.) и возбужденном состоянии (в. с.).

В – валентность, которая совпадает с числом неспаренных электронов. н. с., степень окисления равна +1, валентность равна 1.
У галлия на внешнем энергетическом уровне есть свободные 4р- орбитали, поэтому один электрон с 4s-орбитали при возбуждении перейдет на свободную 4р-орбиталь:
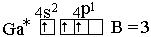
* – возбужденное состояние.
в. с., степень окисления – +3.
Галлий имеет три валентных электрона на s- и р-орбитали внешнего энергетического уровня. В невозбужденном состоянии неспарен только р-электрон. Соответственно в соединениях эти элементы могут проявлять степень окисления +1. Однако, для элементов IIIA-группы более характерна степень окисления +3. это обусловлено тем, что переход электронов с s- на р-подуровень требует не очень большой затраты энергии (возбужденное состояние). Затраты полностью компенсируются при образовании дополнительных химических связей.
Оксид Ga2О3 и гидроксид Ga(ОН)3 амфотерны.
Ga2О3 – амфотерный оксид, основная и кислотная функции проявляются примерно в одинаковой степени.
Ga2О3 + 6HCl ® GaCl3 + 3H2О
Ga2О3 + 6NaOH + 3H2О ® 2Na3[Ga(OH)6]
Производные Ga+1 неустойчивы и являются сильными восстановителями.
Скандий располагается в IV периоде (следовательно, у него 4 энергетических уровня), III группе (следовательно, сумма валентных электронов равна 3) побочной подгруппе (следовательно, валентными являются s-электроны внешнего энергетического уровня и d-электроны предвнешнего энергетического уровня; на внешнем энергетическом уровне находится 2 электрона).
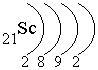 – распределение электронов по энергетическим уровням
– распределение электронов по энергетическим уровням
Электронная формула: 1s2 2s22p6 3s23p6 4s23d1.
валентные электроны: 4s23d1 – это d-элемент.
Электронно-графическая формула скандия:

Определяем валентные возможности скандия, для этого распишем валентные электроны атома по орбиталям в нормальном (н. с.) и возбужденном состоянии (в. с.).

н. с., степень окисления равна +1, валентность равна 1.
У скандия на внешнем энергетическом уровне есть свободные 4р- орбитали, поэтому один электрон с 4s-орбитали при возбуждении перейдет на свободную 4р-орбиталь; электрон с 3 энергетического уровня перейти на 4 энергетический уровень не может:

* – возбужденное состояние.
в. с., степень окисления – +3.
Для скандия характерна только степень окисления +3.
Соединение с кислородом: 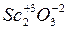 – амфотерный оксид (по химическим свойствам напоминает Al2O3).
– амфотерный оксид (по химическим свойствам напоминает Al2O3).
Sc2O3 + 6HCl ® 2ScCl3 + 3H2O
Sc2O3 + 2NaOH ® NaScO2 + H2O
метаскандинат
натрия
Дата публикования: 2014-11-04; Прочитано: 21956 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
