 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
И реальных газов
|
|
Реальные газы при низких давлениях близки к идеальным, так как в этом случае можно пренебречь силами межмолекулярного взаимодействия и объемом молекул. Это относится, в частности, к кислороду, воздуху, находящимся при высоких температурах и относительно низких давлениях. При нормальных условиях отклонение основных параметров состояния не превышает 3%.
Именно идеальные газы подчиняются законам Бойля-Мариотта, Гей-Люссака и Авогадро.
1. Закон Бойля-Мариотта установлен опытным путем. Если постоянное количество газа, например 1 кг, при постоянной температуре (Т1 = Т2) будет переходить из одного состояния с параметрами р1, J1 в другое состояние с параметрами р2, J2, то его давление будет изменяться обратно пропорционально объему
р1 / р2 = J2/J1 (7)
или
р1 J1 = р2 J2 = const. (8)
Следовательно, при постоянной температуре произведение давления на объем данной массы газа есть величина постоянная.
2. Закон Гей-Люссака. Если нагревать или охлаждать одно и то же количество газа (1 кг) при постоянном давлении (р1 = р2), то объем газа изменяется прямо пропорционально его абсолютной температуре:
J1/J2 = Т1 / Т2 (9)
3. Закон Авогадро. В равных объемах разных газов содержится одинаковое число молекул, если эти газы имеют одинаковые давление и температуру.
Из закона Авогадро следует, что при одинаковых температурах и давлениях плотность r газов пропорциональна их молекулярным массам m:
р1 / р2 = m1/m2 (10)
Так как
r = 1/J, то m1J1 = m2J2 (12)
Если принять, что m – масса газа (кг), численно равная молекулярной массе, то mJ = Vm – объему 1 киломоля любого газа.
При нормальных условиях (р = 760 мм рт. ст.; t = 0 0C)
Vm = 22,4 м3/кмоль, то есть (12)
mJ = 22,4 м3/кмоль,
отсюда
J = Vm/ m (13)
В реальных газах в отличие от идеальных существуют силы межмолекулярных взаимодействий, поэтому в расчетах необходимо учитывать собственный объем молекул. В результате уже при условиях, незначительно отличных от нормальных, углекислый газ и некоторые другие газы практически не подчиняются законам идеальных газов.
Для равновесного состояния идеального газа существует однозначная зависимость между его основными параметрами r, J, и Т. Зависимость выражается уравнением Клапейрона:
для 1 кг газа – рJ = RT (14)
для произвольной массы газа – G
pV = GRT. (15)
Уравнению (14) можно придать универсальную форму, если отнести газовую постоянную R, Дж/(кг . К), к одному киломолю газа, то есть при G = m и, следовательно, V = Vm, то есть
pVm = mRT. (16)
Впервые эта форма записи уравнения состояния предложена Д. И. Менделеевым, и оно получило название уравнение Менделеева-Клапейрона.
Величина mR называется универсальной газовой постоянной, так как для всех газов и в любом состоянии она имеет одно и то же значение. Определим ее численное значение при нормальных условиях (r = 760 мм рт. ст. = 101325 Па; t = 0 0C):
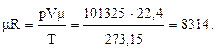
Газовая постоянная R равна:
R = 8314/m. (17)
Как видно по единицам измерения, mR и R есть работа, которую совершает либо 1 кмоль, либо 1 кг газа при изменении температуры на 1 К.
Дата публикования: 2014-11-04; Прочитано: 493 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
