 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Марганец
|
|
Марганец – элемент 4‑го периода и VIIB‑группы Периодической системы, порядковый номер 25. Электронная формула атома [18Ar]3d54s2; характерные степени окисления +VII, +VI, +IV, +II и 0.
Шкала степеней окисления марганца:

По электроотрицательности (1,60) марганец занимает промежуточное положение между типичными металлами (Na, К, Са, Mg) и неметаллами (F, О, N, Cl). Соединения MnII – оксид и гидроксид – проявляют основные свойства, соединения MnIII и MnIV – амфотерные свойства, для соединений MnVI и MnVII характерно почти полное преобладание кислотных свойств. Марганец образует многочисленные соли и бинарные соединения.
В природе – четырнадцатый по химической распространенности элемент (восьмой среди металлов; второй, после железа, тяжелый металл).
Марганец Mn. Серебристо‑белый (с серым оттенком) металл, более твердый и хрупкий по сравнению с железом. В виде мелкого порошка пирофорен. На воздухе покрывается оксидной пленкой. Пассивируется в воде, поглощает водород, но не реагирует с ним.
При нагревании сгорает в кислороде воздуха, реагирует с хлором и серой:

В ряду напряжений марганец стоит левее водорода, из разбавленных кислот HCl и H2SO4 вытесняет водород:
Mn (порошок) + 2H+ = Mn2+ + Н2↑
Взаимодействует с кислотами‑окислителями при нагревании, также образуя соли марганца (II):
Mn + 2H2SO4 (конц.) = MnSO4 + SO2↑ + 2Н2O
ЗMn + 8HNO3 (разб.) = 3Mn(NO3)2 + 2NO↑ + 4Н2O
Получение марганца в промышленности – восстановление пиролюзита MnO2 или гаусманита (MnIIMn2III)O4коксом или алюминием:
MnO2 + С (кокс) = Mn + СO2 (600 °C)
3(MnIIMn2III)O4 + 8Al = 9 Mn + 4Al2O3 (700–900 °C)
Наиболее чистый марганец выделяют электролизом раствора из солей марганца(II), например:
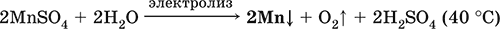
Промышленно важен сплав с железом – ферромарганец (> 70 % Mn), его получают восстановлением оксидных руд марганца и железа.
Применяется марганец для изготовления специальных и тугоплавких сплавов, зеркального чугуна и марганцевых твердых сталей, в качестве катализатора в органическом синтезе.
Оксид марганца (IV) MnO2. Черный, с коричневым оттенком, при нагревании разлагается. Из раствора осаждается в виде черного гидрата MnO2 nН2O. Не проявляет амфотерных свойств в силу малой реакционной способности по отношению к воде, разбавленным кислотам НCl и H2SO4, азотной кислоте и щелочам в растворе. Типичный окислитель в растворе и расплаве, менее характерны свойства восстановителя.
Применяется для промышленного производства марганца, как деполяризатор в «батарейках» (сухих гальванических элементах), компонент минеральных пигментов, осветлитель стекла.
Уравнения важнейших реакций:
4MnO2 = 2Mn2O3 + O2 (530–585 °C)
2MnO2 + 2H2SO4 (конц.) = MnSO4 + O2↑ + 2Н2O (кипячение)
MnO2 + 4HCl (конц.) = MnCl2 + Cl2↑ + 2H2O
MnO2 + H2SO4 (гор.) + KNO2 = MnSO4 + KNO3 + H2O
MnO2 + 2H2SO4 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
MnO2 + 2KOH + KNO3 = K2MnO4 + KNO2 + H2O (350–450 °C)
3MnO2 + 3K2CO3 + KClO3 = 3K2MnO4 + KCl + 3CO2 (400 °C)
В природе самое распространенное соединение марганца – минерал пиролюзит.
Манганат калия К2MnO4. Оксосоль. Темно‑зеленый, плавится под избыточным давлением O2. В растворе устойчив только в сильнощелочной среде. Зеленая окраска раствора отвечает иону MnO42‑. Медленно разлагается при разбавлении раствора водой, быстро – при подкислении. Проявляет окислительно‑восстановительные свойства.
Качественная реакция – появление фиолетовой окраски при подкислении раствора. Промежуточный продукт при синтезе КMnO4.
Уравнения важнейших реакций:

Получение: сплавление MnO2 с сильными окислителями (KNO3, КСlO3).
Пермапгапат калия КMnO4. Оксосоль. Красно‑фиолетовый (почти черный). При нагревании разлагается без плавления. Умеренно растворим в воде (интенсивно‑фиолетовая окраска раствора отвечает иону MnO4‑), гидролиза нет. Медленно разлагается в воде, серной кислоте, щелочах. Сильный окислитель в растворе и при сплавлении; в сильнокислотной среде восстанавливается до MnII, в нейтральной среде – до MnIV, в сильнощелочной среде – до MnVI.
Качественная реакция на ион MnO4‑ – исчезновение фиолетовой окраски раствора при восстановлении в кислотной среде.
Применяется как окислитель углеводородов до карбоновых кислот, реактив в фотографии, антисептик в медицине, средство для очистки газов и отбеливания тканей, твердый источник кислорода. Распространенный окислитель в лабораторной практике.
Уравнения важнейших реакций:


Получение – электролиз раствора K2MnO4 (см.).
Железо
Железо – элемент 4‑го периода и VIIIБ‑группы Периодической системы, порядковый номер 26. Вместе с кобальтом Со и никелем Ni образует семейство (триаду) железа. Электронная формула атома [18Ar]3d64s2, характерные степени окисления 0, +II и +III (последняя наиболее устойчива).
Шкала степеней окисления железа:

По электроотрицательности (1,64) железо занимает промежуточное положение между типичными металлами (Na, Са) и типичными неметаллами (F, О, N). Проявляет амфотерные свойства, металлические (основные) свойства преобладают над неметаллическими (кислотными), в соединениях находится в составе катионов (чаще) и анионов (реже). Образует многочисленные соли и бинарные соединения.
В природе – седьмой по химической распространенности элемент (четвертый среди металлов, первый тяжелый металл); находится в химически связанном виде. Жизненно важный элемент для всех организмов.
Железо Fe. Простое вещество. Серый мягкий, ковкий, тугоплавкий металл. Обычное железо медленно окисляется во влажном воздухе (ржавеет), чистое железо коррозии не подвергается. Не реагирует с водой, пассивируется в концентрированных серной и азотной кислотах.
Компактный металл покрывается при нагревании на воздухе оксидной пленкой (окалиной), а порошок сгорает; реагирует с хлором и серой:

Восстанавливает водяной пар (старый способ получения водорода в промышленности):
3Fe + 4Н2O (пар) = (FeIIFe2III)O4+ 4Н2 (800 °C)
В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НCl и H2SO4, при этом образуются соли железа(II) и выделяется водород:
Fe + 2Н+ = Fe2+ + Н2↑
(реакции проводятся без доступа воздуха, иначе FeII постепенно переводится кислородом в FeIII).
При действии на железо более сильного окислителя (здесь – азотная кислота) оно сразу переходит в катион Fe3+:
Fe + 4HNO3 (разб.) = Fe(NO3)3 + NO↑ + 2H2O
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fe + 2NaOH (50 %) + 2Н2O = Na2[Fe(OH)4]↓ + Н2↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Железо вытесняет (по ряду напряжений) менее активные металлы из растворов их солей:
Fe + CuSO4 = FeSO4 + Cu↓
Железо медленно окисляется во влажном воздухе (ржавеет), из‑за рыхлости коричневой ржавчины (FeIIFe2III)O4 защитный слой не создается. Процесс ржавления:
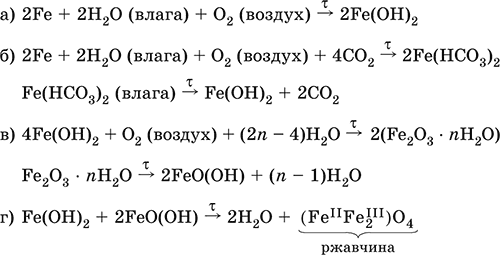
Техническое железо – сплавы железа с углеродом: чугун содержит 2,06–6,67 % С, сталь 0,02–2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Mn, Ni, Cr), что придает сплавам железа технически полезные свойства – твердость, термическую и коррозионную стойкость, ковкость и др.
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд – перевод в оксидную руду:

б) сжигание кокса при горячем дутье:

в) восстановление оксидной руды угарным газом СО последовательно (см. рубрики соответствующих оксидов):

г) науглероживание железа (до 6,67 % С) и расплавление чугуна:

В чугуне всегда в виде зерен присутствуют цементит Fe2C и графит.
Производство стали
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700–2000 °C. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СO2, SO2), либо связываются в легко отделяемый шлак – смесь Са3(РO4)2 и CaSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение чистого железа в промышленности – электролиз раствора солей железа, например:

(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун – в производстве литья и стали, сталь – как конструкционный и инструментальный материалы, в том числе износо‑, жаро– и коррозионно‑стойкие.
Оксид железа(II) FeO. Амфотерный оксид с большим преобладанием основных свойств. Черный, имеет ионное строение Fe2+O2‑. При нагревании вначале разлагается, затем образуется вновь. Не образуется при сгорании железа на воздухе. Не реагирует с водой. Разлагается кислотами, сплавляется со щелочами. Медленно окисляется во влажном воздухе. Восстанавливается водородом, коксом. Участвует в доменном процессе выплавки чугуна. Применяется как компонент керамики и минеральных красок. Уравнения важнейших реакций:

Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
Fe(OH)2 = FeO + H2O (150–200 °C)
FeCO3 = FeO + СO2 (490–550 °C)
Оксид дижелеза (III) – железа(II) (FeIIFe2III)O4. Двойной оксид. Черный, имеет ионное строение Fe2+(Fe3+)2(O2‑)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто‑формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций:
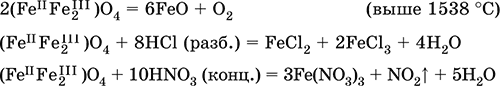

Получение: сгорание железа (см.) на воздухе.
В природе – оксидная руда железа магнетит.
Оксид железа(III) Fe2O3. Амфотерный оксид с преобладанием основных свойств. Красно‑коричневый, имеет ионное строение (Fe3+)2(O2‑)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fe2O3 nН2O. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с оксидами других металлов и образует двойные оксиды – шпинели (технические продукты называются ферритами). Применяется как сырье при выплавке чугуна в доменном процессе, катализатор в производстве аммиака, компонент керамики, цветных цементов и минеральных красок, при термитной сварке стальных конструкций, как носитель звука и изображения на магнитных лентах, как полирующее средство для стали и стекла.
Уравнения важнейших реакций:

Получение в лаборатории – термическое разложение солей железа(III) на воздухе:
Fe2(SO4)3 = Fe2O3 + 3SO3 (500–700 °C)
4{Fe(NO3)3 9 H2O} = 2FeaO3 + 12NO2 + 3O2 + 36H2O (600–700 °C)
В природе – оксидные руды железа гематит Fe2O3 и лимонит Fe2O3 nН2O.
Гидроксид железа (II) Fe(OH)2. Амфотерный гидроксид с преобладанием основных свойств. Белый (иногда с зеленоватым оттенком), связи Fe – ОН преимущественно ковалентные. Термически неустойчив. Легко окисляется на воздухе, особенно во влажном состоянии (темнеет). Нерастворим в воде. Реагирует с разбавленными кислотами, концентрированными щелочами. Типичный восстановитель. Промежуточный продукт при ржавлении железа. Применяется в изготовлении активной массы железоникелевых аккумуляторов.
Уравнения важнейших реакций:

Получение: осаждение из раствора щелочами или гидратом аммиака в инертной атмосфере:
Fe2+ + 2OН(разб.) = Fe(OH)2↓
Fe2+ + 2(NH3 H2O) = Fe(OH)2 ↓ + 2NH4+
Метагидроксид железа FeO(OH). Амфотерный гидроксид с преобладанием основных свойств. Светло‑коричневый, связи Fe – О и Fe – ОН преимущественно ковалентные.
При нагревании разлагается без плавления. Нерастворим в воде. Осаждается из раствора в виде бурого аморфного полигидрата Fe2O3 nН2O, который при выдерживании под разбавленным щелочным раствором или при высушивании переходит в FeO(OH). Реагирует с кислотами, твердыми щелочами. Слабый окислитель и восстановитель. Спекается с Fe(OH)2. Промежуточный продукт при ржавлении железа. Применяется как основа желтых минеральных красок и эмалей, поглотитель отходящих газов, катализатор в органическом синтезе.
Соединение состава Fe(OH)3 не известно (не получено).
Уравнения важнейших реакций:

Получение: осаждение из раствора солей железа(III) гидрата Fe2O3 nН2O и его частичное обезвоживание (см. выше).
В природе – оксидная руда железа лимонит Fe2O3 nН2O и минерал гётит FeO(OH).
Феррат калия K2FeO4. Оксосоль. Красно‑фиолетовый, разлагается при сильном нагревании. Хорошо растворим в концентрированном растворе КОН, реагирует с кипящей водой, неустойчив в кислотной среде. Сильный окислитель. Качественная реакция – образование красного осадка феррата бария. Применяется в синтезе ферритов – промышленно важных двойных оксидов железа (III) и других металлов.
Уравнения важнейших реакций:

Получение: образуется при окислении соединений железа, например метагидроксида FeO(OH), бромной водой, а также при действии сильных окислителей (при спекании) на железо
Fe + 2KOH + 2KNO3 = K2FeO4 + 3KNO2 + H2O (420 °C)
и электролизе в растворе:

(феррат калия образуется на аноде).
Качественные реакции на ионы Fe2+ и Fe3+. Обнаружение ионов Fe2+ и Fe3+ в водном растворе проводят с помощью реактивов K3[Fe(CN)6] и K4[Fe(CN)6] соответственно; в обоих случаях выпадает синий продукт одинакового состава и строения, KFeIII[FeII(CN)6]. В лаборатории этот осадок называют берлинская лазурь, или турнбуллева синь:
Fe2+ + К+ + [Fe(CN)6]3‑ = KFeIII[FeII(CN)6]↓
Fe3+ + K+ + [Fe(CN)6]4‑ = KFeIII[FeII(CN)6]↓
Химические названия исходных реактивов и продукта реакций:
K3[Fe(CN)6] – гексацианоферрат (III) калия
K4[Fe(CN)6] – гексацианоферрат (II) калия
KFeIII[FeII(CN)6] – гексацианоферрат (II) железа(III) калия
Кроме того, хорошим реактивом на ионы Fe3+ является тиоцианат‑ион NCS‑, железо (III) соединяется с ним, и появляется ярко‑красная («кровавая») окраска:
Fe3+ + 6NCS– = [Fe(NCS)6]3‑
Этим реактивом (например, в виде соли KNCS) можно обнаружить даже следы железа (III) в водопроводной воде, если она проходит через железные трубы, покрытые изнутри ржавчиной.
Дата публикования: 2014-11-04; Прочитано: 4624 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
