 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Зависимость концентраций реагирующих веществ от длины реактора идеального вытеснения
|
|
Из определения реактора идеального вытеснения следует, что длина аппарата однозначно связана с временем протекания реакции, коэффициентом пропорциональности является линейная скорость потока 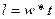 .
.
Зависимость концентраций реагирующих веществ от времени превращения определяется в первую очередь схемой превращения. Анализируя схему реакции, нужно представить себе общую тенденцию изменения концентрации каждого вещества, участвующего в реакции. На этом уровне следует понять, с какой величины начинается временная зависимость концентрации каждого вещества и к чему стремится эта концентрация с ростом времени реакции. Концентрация реагента начинается с некоторой фиксированной величины (начальная концентрация, концентрация на входе в реактор), концентрация продукта реакции обычно равна нулю в начале реакции. Чтобы узнать, к какому значению устремится концентрация каждого вещества, нужно представить себе общий ход реакции. Исходное вещество либо полностью расходуется, либо его концентрация стремится к равновесному значению, если реакция стремится к равновесию. Концентрации продуктов стремятся либо к нулю (если продукт неограниченно расходуется в ходе реакции), либо к определенной величине, зависящей от стехиометрии реакции (если продукт не расходуется) либо к равновесию. Далее нужно учесть стехиометрию рассматриваемой реакции. Подход здесь такой же, как описанный для решения первой расчетной задачи. И, наконец, нужно оценить влияние кинетических характеристик реакции на вид рассматриваемых зависимостей. В зависимости от соотношения скоростей стадий реакции изменится соотношение концентраций реагирующих веществ, скорости стадий зависят от концентраций веществ, исходных в этой стадии, и от значений констант скоростей. Характер изменения концентраций определяется схемой превращения, значения констант в этой задаче обычно не задаются. При построении графиков следует принимать соизмеримые значения констант скоростей стадий (но не равные между собой), хотя для предварительного анализа бывает полезно принять некоторые константы пренебрежимо малыми по сравнению с другими, или равными между собой.
Рассмотрим несколько примеров, используя рассмотренную последовательность: 1-анализ схемы реакции, 2-анализ стехиометрических соотношений,3-учет кинетики.
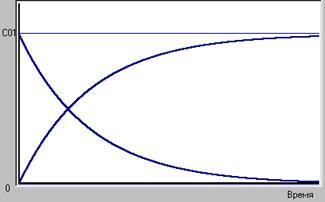
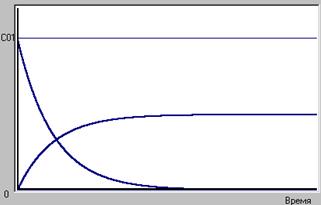
Простейшая реакция 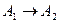 .
.
Из анализа схемы реакции ясно, что концентрация реагента, имеющая вначале исходное значение (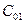 ) будет стремиться к нулю, так как ничто не мешает реагенту безостановочно расходоваться. Концентрация продукта, начавшись с нулевой будет непрерывно увеличиваться и при полном израсходовании реагента устремится к значению, определяемому стехиометрическим соотношением. Для этой реакции при полном израсходовании реагента получится столько продукта, сколько израсходовалось реагента, т.е.
) будет стремиться к нулю, так как ничто не мешает реагенту безостановочно расходоваться. Концентрация продукта, начавшись с нулевой будет непрерывно увеличиваться и при полном израсходовании реагента устремится к значению, определяемому стехиометрическим соотношением. Для этой реакции при полном израсходовании реагента получится столько продукта, сколько израсходовалось реагента, т.е. 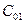 (рис.1)
(рис.1)
 .
.
Рис.1
Стехиометрия, естественно должна соблюдаться и по ходу реакции, что легко проверить, определив в любом временном сечении количество прореагировавшего реагента (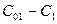 ) и количество образовавшегося продукта (
) и количество образовавшегося продукта (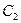 - 0), которые должны быть равны друг другу. Кривые получаются симметричными. Анализ кинетики для одностадийной реакции сведется к тому, что при увеличении константы скорости обе концентрации будут меняться быстрее, и кривые пойдут круче, оставаясь симметричными.
- 0), которые должны быть равны друг другу. Кривые получаются симметричными. Анализ кинетики для одностадийной реакции сведется к тому, что при увеличении константы скорости обе концентрации будут меняться быстрее, и кривые пойдут круче, оставаясь симметричными.
Повторим те же рассуждения для реакции 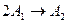 . Из анализа схемы реакции ясно, что концентрация реагента, имеющая вначале исходное значение (
. Из анализа схемы реакции ясно, что концентрация реагента, имеющая вначале исходное значение (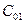 ) будет стремиться к нулю, так как ничто не мешает реагенту безостановочно расходоваться. Концентрация продукта, начавшись с нулевой будет непрерывно увеличиваться и при полном израсходовании реагента устремится к значению, определяемому стехиометрическим соотношением. Для этой реакции при полном израсходовании реагента получится в два раза меньше продукта, чем израсходовалось реагента[1], т.е.
) будет стремиться к нулю, так как ничто не мешает реагенту безостановочно расходоваться. Концентрация продукта, начавшись с нулевой будет непрерывно увеличиваться и при полном израсходовании реагента устремится к значению, определяемому стехиометрическим соотношением. Для этой реакции при полном израсходовании реагента получится в два раза меньше продукта, чем израсходовалось реагента[1], т.е. 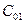 /2 (рис.2)
/2 (рис.2)
 .
.
Рис.2
Стехиометрия, естественно должна соблюдаться и по ходу реакции, что легко проверить, определив в любом временном сечении количество прореагировавшего реагента (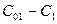 ) и количество образовавшегося продукта (
) и количество образовавшегося продукта (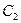 - 0), которые должны находиться в соотношении 2:1. Кривые не получаются симметричными. Анализ кинетики для одностадийной реакции сведется к тому, что при увеличении константы скорости обе концентрации будут меняться быстрее, и кривые пойдут круче, оставаясь симметричными.
- 0), которые должны находиться в соотношении 2:1. Кривые не получаются симметричными. Анализ кинетики для одностадийной реакции сведется к тому, что при увеличении константы скорости обе концентрации будут меняться быстрее, и кривые пойдут круче, оставаясь симметричными.
Обратимая реакция 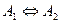 .
.
Отличие от простейшей реакции будет состоять только в том, что концентрации реагента и продукта будут стремиться к равновесным значениям (рис.3).
. 
Рис.3
Последовательная реакция: 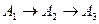 .
.
Из анализа схемы превращения понятно, что концентрация реагента, начинаясь с 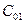 стремится к нулю. Концентрация промежуточного продукта, который образуется и расходуется одновременно, сначала будет расти, затем уменьшаться и стремиться к нулю. Концентрация конечного продукта, начинаясь с нуля, устремится к
стремится к нулю. Концентрация промежуточного продукта, который образуется и расходуется одновременно, сначала будет расти, затем уменьшаться и стремиться к нулю. Концентрация конечного продукта, начинаясь с нуля, устремится к 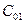 . Взаимное расположение этих кривых определяется стехиометрическими соотношениями. Так, если к какому-то моменту времени израсходовалось
. Взаимное расположение этих кривых определяется стехиометрическими соотношениями. Так, если к какому-то моменту времени израсходовалось 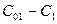 реагента и получилось
реагента и получилось 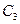 конечного продукта, то промежуточного продукта должно быть
конечного продукта, то промежуточного продукта должно быть 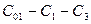 (рис.4). На вид кривых влияют и кинетические характеристики. Увеличение констант скоростей обеих стадий приведет к более быстрому изменению всех концентраций (ось времени как бы сжимается), а изменение соотношения констант повлияет на величину и положение максимума на кривой промежуточного вещества.
(рис.4). На вид кривых влияют и кинетические характеристики. Увеличение констант скоростей обеих стадий приведет к более быстрому изменению всех концентраций (ось времени как бы сжимается), а изменение соотношения констант повлияет на величину и положение максимума на кривой промежуточного вещества.

Рис.4
Параллельная реакция 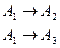 .
.
Реагент израсходуется полностью, его концентрация устремится к нулю. Часть израсходованного реагента превратится в продукт 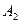 , оставшийся реагент – в продукт
, оставшийся реагент – в продукт 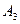 , т.е. стехиометрический баланс
, т.е. стехиометрический баланс 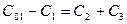 должен соблюдаться в любой временной точке. Абсолютные концентрации продуктов определяются кинетикой – если скорость первой стадии больше скорости второй, то продукта первой стадии образуется больше (рис.5).
должен соблюдаться в любой временной точке. Абсолютные концентрации продуктов определяются кинетикой – если скорость первой стадии больше скорости второй, то продукта первой стадии образуется больше (рис.5).

Рис.5
И, наконец, рассмотрим два случая последовательной реакции, включающей обратимую стадию.
Реакция 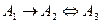 .
.
Реагент непрерывно расходуется и его концентрация стремится к нулю. Между двумя продуктами в конце концов установится равновесие, характеризующееся равновесными концентрациями продуктов. И в любой точке соблюдаются стехиометрические соотношения (рис.6).

Рис.6
Если же обратимой стадией является первая 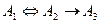 , то равновесие не установится, промежуточное вещество непрерывно расходуется и его концентрация стремится к нулю, что заставит и концентрацию реагента стремиться к нулю (рис.7).
, то равновесие не установится, промежуточное вещество непрерывно расходуется и его концентрация стремится к нулю, что заставит и концентрацию реагента стремиться к нулю (рис.7).
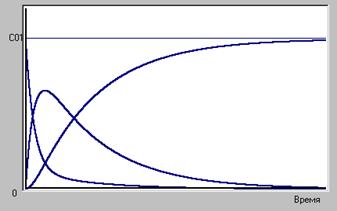
Рис.7
Дата публикования: 2015-11-01; Прочитано: 544 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
