 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Конкурент емес ингибитордың тежеу механизмі
|
|
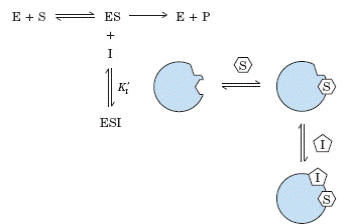
Тәжірибе жүзінде конкурентті емес және аралас тежелулер екі немесе одан да көп субстрат түрлері (S1 және S2) бар ферменттерде ғана байқалады. Егер ингибитор қалыпты жағдайдадағы S1–дің орнына байланысса – ол конкурентті ингибитор болып шығады. Ал, егер ингибитор қалыпты жағдайдадағы S2–нің орнына байланысса – ол S1–дің конкурентті немесе аралас ингибиторы болып табылады.

Тежеудің шын мәніндегі жолдары S1- және S2–байланыстарының құрылу кезегіне тәуелді болып отырады, сондықтан субстраттың байланысу және өнімнің бөлініп кету тәртібін білу маңызды. Реакция өнімдерінің біреуін ингибитор ретінде пайдаланып, өте маңызды мәлімет алуға болады. Егер екі реакцияның өнімдерінің тек бірі қатысса – онда кері реакция жүрмейді. Бірақ, жалпы алғанда, өнім активті орталықтың бір бөлігімен байланысып, ингибитор қасиетін көрсете алады.
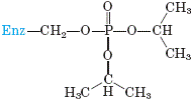
Қайтымсыз тежелу. Ферменттің активтігі үшін қажет функционалды топтармен ковалентті байланысатын (ковалентті болмаса да өте тұрақты байланысатын) немесе ондай топтарды бұзатын, қайтымсыз тежелуді іске асыратын қосылыстарды қайтымсыз ингибиторлар деп атайды. Фермент активтігін жоғалтқаннан кейін, қандай амин қышықылының қалдығы ингибитормен байланысатынын зерттеу арқылы ферменттің активті орталығында катализ кезінде шешуші роль атқаратын амин қышқылдарын анықтауға болады. Мысалы, химотрипсиннің диизопропилфторфосфатпен реакциясы ферментті қайтымсыз тежейді. Бұл нәтиже 195-ші сериннің осы ферменттің активті орталылығында шешуші роль атқарады деген қортынды жасауға мүмкіндік береді.
Ші серин



Дата публикования: 2015-11-01; Прочитано: 1177 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
