 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Влияние синхронизации клеточного деления на микробную популяцию
|
|
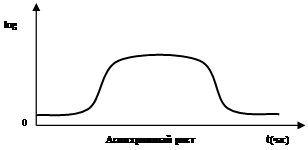
Кривые роста, предоставленные в виде зависимости числа клеток от времени культивирования иногда показывают необычно быстрое увеличение числа клеток сразу после лаг-фазы, вслед за чем скорость накопления клеток понижается. Такое необычное значительное ускорение роста связанно с частичной или полной синхронизацией деления клеток в культуре.
Синхронный рост может быть обусловлен приспособлением культуры к новому питательному субстрату, после чего происходит одновременное деление клеток, в результате одновременного прорастания спор в вегетативные клетки. Затем синхронность культуры быстро нарушается и через 2-3 генерации преобладает обычный асинхронный рост.
В настоящее время разработаны специальные методы, с помощью которых можно синхронизировать деление клеток в растущей популяции, так что рост популяции соответствует росту отдельных клеток. К синхронизации роста в периодическом режиме культивирования чаще всего прибегают с целью изучения метаболических процессов, связанных с определенными этапами цикла развития индивидуальных клеток. Синхронизация культуры наступает в том случае, когда все клетки начинают делиться с почти одинаковой скоростью При этом зависимость логарифма числа клеток от длительности культивирования приобретает ступенчатый характер в отличии от линейного при обычном асинхронном росте в периодическом режиме культивирования.
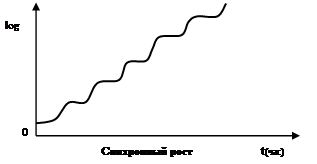
Несмотря на то, что развитие синхронной культуры происходит довольно равномерно, сохранить синхронность в течении длительного времени трудно, поскольку требуется точный контроль.
Синхронизация культуры может быть достигнута путем изменения лимитирующих факторов среды. К числу технических приемов вызывающих синхронизацию деления клеток, относятся подавление, ускорение или задержка их метаболических функций циклическим способом. При этом популяция постепенно синхронизирует свой ответ на периодические колебания метаболической активности, а затем и показатели роста. Однако, этот метод требует значительного вмешательства в нормальный процесс метаболизма, поэтому его использование ограниченно. Единственным исключением является прорастание бактериальных спор как показатель начинающейся синхронизации. Для этого резкими изменениями состава среды стимулируют прорастание спор и тем самым моделируют процессы, близкие к естественным. Однако достичь 100%-го образования спор или их прорастания практически невозможно, да и далеко не все культуры, синхронизировать которые необходимо, являются спорообразующими. Поэтому для получения однородной по своему физиологическому состоянию популяции требуется применение некоторых физических способов предварительной селекции.
Общепринятый метод синхронизации культур основан на физическом выделении гомогенной в физиологическом отношении фракции клеток из гетерогенной популяции. Такой подход называют синхронизацией путем селекции, что позволяет избежать проблем, связанных с нарушением метаболизма.
Любая гетерогенная популяция бактериальных клеток содержит в своем составе клетки готовые к делению, клетки только что разделившиеся и клетки находящиеся в стадии роста (наращивания цитоплазматической массы). Готовые к делению и только что разделившиеся клетки имеют самую высокую плотность, несмотря на различия их в размерах, а клетки, находящиеся в стадии роста, имеют наименьшую плотность, что и позволяет разделить их на различные фракции методом центрифугирования в градиенте плотности. Для более точного фракционирования клеток, по мимо градиенты плотности, избирают скорость и время центрифугирования, в зависимости от видовых особенностей культуры. Фракция с наибольшей плотностью (осадок) обычно содержит и молодые (дочерние) и зрелые (готовые к делению) клетки, а фракция с наименьшей плотностью (надосадочная жидкость)состоит из однородной гомогенной популяции клеток, находящихся в одинаковой стадии роста. Именно эта фракция используется в качестве посевного материала для осуществления синхронного роста.
Отобрав из центрифужной пробирки самую легкую фракцию клеток, её переносят в емкость подогретой ростовой средой. Тщательно измеряют оптическую плотность засеянной среды, чтобы затем определять её ступенчатое увеличение, свидетельствующее о синхронном росте культуры.
Синхронность культуры поддерживается в течение 2-4 циклов деления клеток. Если необходим более длительный период, то синхронность приходится устанавливать заново с помощью тех же технических приемов.
4. Непрерывное (проточное) культивирование микроорганизмов.
Метод проточного непрямого культивирования пришел в микробиологию из химической технологии. Непрерывные процессы имеют значительные преимущества перед периодическими: возможность специализации аппаратуры для каждой стадии непрерывного процесса, стабилизации его во времени, улучшение качества продукции, легкость регулировки и, главное, возможность автоматизации. Этими преимуществами объясняется тенденция в биотехнологии к переходу от периодических процессов к непрерывным.
Принцип непрерывного (проточного) культивирования микробов состоит в том, что в сосуд, где размножаются микроорганизмы, непрерывно подается свежая питательная среда и одновременно втекает такой же объем культуры. По такому принципу организуются две разновидности технического процесса непрерывного культивирования: процесс (технология) полного вытеснения и технология полного смещения.
4.1. Технология полного вытеснения.
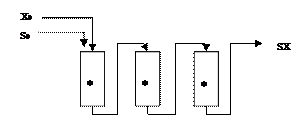
При технологии полного вытеснения сосуд для выращивания микроорганизмов (трубчатый ферментер) представляет собой трубку, расположенную горизонтально или вертикально, в которую втекают среда и посевной материал и вытекает культура. Перемешивание не производится.
 |
S0 – концентрация субстрата в поступающей питательной среде
S – концентрация субстрата в вытекающей питательной среде
Х0 – концентрация биомассы в поступающем посевном материале
Х – концентрация вытекающей биомассы
Таким способом сравнительно легко и несложно культивировать микроорганизмы, не требующие аэрации. С одной стороны ферментера подаются среда и посевной материал, где микробная популяция находится в начале своего развития. По ходу трубки культура «стареет», субстрат исчерпывается, накапливаются продукты метаболизма и вытекающая культура приходит в состояние аналогичное стационарной фазе роста периодической культуры. В результате такого процесса в ферментере воспроизводится полная кривая роста, но не во времени, а в пространстве. В настоящее время появились ферментативные аппараты, обеспечивающие процессы с режимом, приближающимся к полному вытеснению и при аэробном культивировании.
Процесс полного вытеснения применяется в промышленности в тех случаях, когда желательно избежать потери времени на опорожнение, стерилизацию и заполнение емкости. Его применяют в пищевой промышленности, когда используются сложные среды и стоит задача наиболее экономично провести процесс аналогичный тому, который ведется в периодическом режиме.
Пример практического применения рубчатого ферментера – анаэробная стадия при производстве пива в бешенных проточных емкостях. В этих случаях не требуется аэрации и процесс идет без перемешивания. Если этот процесс аэробный, то его ведут в батарее аэрируемых ферментеров. При этом кривая роста периодической культуры распределяется по ходу батарее.
4.2. Технология полного смешивания.
В процессе полного смешивания рост культур происходит в емкости – ферментере при интенсивном перемешивании. Перемешивание достигается продуванием воздуха или работой мешалки (или тем и другим одновременно). Во всей массе культуры условия должны быть совершенно одинаковыми. В ферментере создаются условия соответствующие одной точки кривой роста культуры. При больших потоках среды эти условия близки к фазе логарифмического роста, при малых – приближаются к условиям стационарной фазы роста культур. При таком методе может быть воспроизведена любая точка роста периодической культуры. В установившемся режиме скорость потока среды, отнесенная к объему культуры в ферментере, называют коэффициентом разбавления. Коэффициент разбавления равняется удельной скорости роста µ.
D = 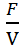 = µ
= µ
где:
D – коэффициент добавления
F – скорость потока среды
V – объем культуры в ферментере
µ- удельная скорость роста
Это означает, что культура находится в устойчивом стационарном состоянии, в результате концентрация биомассы (Х) в ферментере остается постоянной. В таком случае скорость роста определяется коэффициентом разбавления. Она уравнивается с ним и концентрация субстрата (S) также остается постоянной (равномерно расходуемый субстрат обновляется с равномерной скоростью притока новой питательной среды).
При таком способе культивирования культура (вследствие возникновения феномена синхронизации роста) обладает способностью самостоятельно автоматически подстраиваться к измененным условиям процесса. Если условия изменяются в сторону ускорения роста, то в ферментере повышается концентрация биомассы и понижается концентрация субстрата, при замедлении роста – концентрация биомассы понизится, а концентрация питающего субстрата повысится.
При кратковременном изменении условий культивирования эти состояния микробной популяции обратимы и на изменение скорости потока культура реагирует соответствующим изменением концентрации биомассы и концентрации субстрата, не выходя из стационарного состояния. Однако, следует помнить, что чрезмерное увеличение скорости потока, причины сильно замедляющие рост, могут привести к тому, сто скорость роста (µ) окажется меньше коэффициента разбавления (F). И в таком случае культура вымоется из ферментера.
Воспроизведение в потоке определенной точки кривой роста культур широко применяется в промышленности при наращивании биомассы микроорганизмов. Хорошо отработанный периодический процесс выращивания экономически выгодно воспроизводить в проточном варианте, поскольку культура непрерывно находится в состоянии максимальной активности нужного процесса, не тратится время на освобождение емкостей и лаг-фазу.
При наращивании биомассы в проточных условиях биотехнологический процесс стремятся вести при возможно большей скорости потока, но не настолько большой, чтобы в среде оставался недоиспользованный субстрат. Таким образом получают наибольший экономический коэффициент, который при непрерывном культивировании определяют следующим образом:
D  =
= 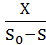
где:
S0 – концентрация питательного вещества в поступающей среде
S – концентрация питательного вещества в культуре, вытекающей из ферментера
Х – концентрация биомассы в вытекающей культуре
4.3. Биотехнологическая реализация способов непрерывного культивирования микроорганизмов.
Существует много способов непрерывного культивирования микроорганизмов, но в биопромышленности в основном применяются два типа:
- Хемостатный, при котором состояние равновесия или стационарное состояние достигается путем регулирования поступления лимитирующих рост субстратов;
- Турбидостатный, при котором состояние равновесия или стационарное состояние культуры достигается путем удаления биомассы и замещения её свежей средой со скоростью равной скорости роста культуры.
Хемостат в отличии от турбидостата позволяет с высокой скоростью регулировать условия лимитирования роста (субстратное лимитирование), тогда как турбидостат предпочтительнее для изучения микроорганизмов в условиях близких к максимальной удельной скорости роста.
4.3.1. Хемостатный способ культивирования
Хемостатное культивирование основано на том, что в простейшей форме рост бактерий можно предоставить как совокупность реакций, в которых скорость роста культуры определяется самой медленной реакцией метаболизма. Хотя в растущей культуре осуществляется метаболизм многих питательных веществ, скорость роста культуры в любой момент времени определяется скоростью метаболизма лишь одного питательного субстрата. Тот субстрат, или тот компонент питательной среды, метаболизм которого осуществляется медленнее всего и который таким образом определяет скорость роста бактериальной культуры, принято называть лимитирующим фактором.
Каким же образом скорость роста культуры зависит от концентрации лимитирующего субстрата? Эту зависимость установил Моно и выразил её следующей формулой:
УРАВНЕНИЕ МОНО
µ =µмах* 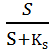
где:
µ - удельная скорость роста
µмах – максимально возможная скорость роста в данной среде
S – концентрация лимитирующего субстрата в среде
Ks – константа Моно или константа насыщения. Она численно равна концентрации лимитирующего субстрата, замедляющей вдвое µмах (т.е. = S при µ=  µмах)
µмах)
Совершенно очевидно, что концентрация лимитирующего фактора или субстрата в среде ограничивает и концентрацию вырастающей биомассы. В случае полного использования лимитирующего фактора рост и размножение бактериальных клеток прекращается. Концентрация биомассы в ферменте в стационарном состоянии культуры определяется по формуле:
Х = 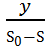
где:
y – экономический коэффициент, или доля потребленного субстрата, пошедшего на синтез биомассы
S0 – концентрация субстрата в поступающей среде
S – концентрация субстрата в ферментере
Концентрацию субстрата в ферментере в стационарном состоянии культуры определяют по формуле:
S = 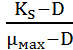
где:
Ks – константа Моно
D – коэффициент разбавления или скорость разбавления
S – концентрация субстрата в ферментере
µмах – максимально возможная скорость роста
Скорость разбавления, или коэффициент разбавления (D) при хемостатном культивировании известен. Он равен:
D= 
где:
F – скорость потока
V – объем культуры
Величина обратная скорости разбавления характеризует время полной замены имеющейся в ферменте среды новой или, что одно и то же, время пребывания в ферментере каждого компонента питательной среды:
t= 
Таким образом, следует рассматривать количественные зависимости, существующие между:
- концентрацией биомассы – Х,
- концентрацией лимитирующего субстрата – S
- скоростью роста - µ
Графически эта зависимость характеризуется хемостатной кривой, которая выглядит следующим образом:

1.Концентрация биомассы
2.Концентрация субстрата
На приведенной кривой видно, что при увеличении скорости разбавления снижается концентрация биомассы и увеличивается концентрация субстрата. Причем, если вести дельнейшее увеличение скорости разбавления, то концентрация (Х) стремится к 0, т.е. при некотором значении (D) биомасса полностью вымывается из фермента. Эту скорость разбавления назначают критической (Dкр.) или скоростью вымывания клеток. Теоретически Dкр= µмах
Но поскольку концентрация лимитирующего субстрата в аппарате (S) не может быть больше концентрации его в поступающей среде (S0), то:
Dкр= µмах* 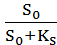
Производительность фермента по выходу (урожаю) биомассы рассчитывают следующим образом:
R=DX
Зная основные константы Ks, µмах и y можно легко рассчитать параметры культуры (Х) и для любого значения при µ=D
Итак, хемостатное культивирование – это вариант непрерывного проточного культивирования с заданным желаемым коэффициентом разбавления (D), к которому подстраивается скорость роста культур µ. Последняя может быть минимальной или близкой к максимальной. При этом задается также фактор (лимитирующий фактор, лимитирующий субстрат, или компонент питательной среды), который обуславливает ограничение концентрации биомассы. Концентрация биомассы определяется одним определенным компонентом питания.
Хемостатный метод культивирования незаменим в лабораторных исследованиях физиологии микроорганизмов и клеток тканей. В промышленности он применяется при наращивании микробной биомассы, если известно, какой именно фактор ограничивает рост.
4.3.2. Турбидостатный способ культивирования.
Турбидостат представляет собой самую простую из всех хорошо перемешиваемых систем непрерывного перемешиваемых систем непрерывного культивирования. Концентрация клеток при турбидостатном культивировании регулируется постоянной подстройкой скорости поступления питательных компонентов. В отличии от хемостата концентрацию биомассы в турбидостате выбирает оператор, а скорость разбавления и соответственно концентрация субстратов поддерживается таким образом, чтобы сохранялся заданный уровень биомассы.
Турбидостатное культивирование осуществляют обычно в тех случаях, когда лимитирующий фактор не известен или в лимитирующих количествах субстрата нет необходимости. Поэтому субстрат добавляется в ферментер в избытке. Избыток концентрации всех компонентов питательной среды делает работу турбидостата стабильной даже при удельной скорости роста культуры близкой к максимальной (µмах). Турбидостат позволяет регулировать систему в широких инервалах концентраций биомассы при скорости разбавления близкой к критической (Dкр). Именно в этих условиях химостат менее стабилен.
Скорость разбавления в турбидостате всегда равна удельной скорости роста:
D=  = µ
= µ
при условии Х=constanta
В свою очередь, постоянство концентрации микробной биомассы удерживают регуляцией скорости потока, которую осуществляет не оператор, а автоматическая система. В большинстве случаев с этой целью прибегают к прямому оптическому измерению мутности биомассы, котороя зависит от концентрации клеток (Х).
Для этого ферментер оборудуют фотоэлектроколлориметром или аналогичным ему устройством, работающем по принципу светорассеявания. Если концентрация клеток остается на нужном уровне питательная среда подается с заданной скоростью, а при снижении концентрации клеток подача питательной среды прекращается. Именно этот принцип работы турбидостата обеспечивает его устойчивую работу даже при коэффициенте разбавления близком к критическому – на границе вымывания клеток.
Сигналом для подачи среды может быть не только оптическая плотность (мутность), но и любой параметр среды, поддающийся измерению электродом или другим устройством, переводящим величину измерительного параметра в величину электрического потенциала. Последний усиливается и приводит в действие работу насоса, подающего раствор или питательную среду.
Поскольку основные метаболические функции (поглощение бактериями кислорода, выделение CO2, изменение рН), тесно связанны со скоростью роста клеток и в конечном счете с удельной скоростью роста культуры, именно эти показатели чаще других используют как измеряемые переменные при регулировке потока среды.
Например, для процессов культивирования имеющих прямую связь между приростом биомассы и изменением значения рН среды, используется рН-статный способ управления скоростью потока среды. Скорость потока с помощью автоматических устройств уравнивается со скоростью изменения рН растущей популяции, а следовательно, и со скоростью роста культур. Это обеспечивает поддержание рН на заданном уровне, а скорость роста является максимальной в данных условиях. Изменяя условия, можно проследить за соответствующими изменениями максимальной скорости роста культур. В последнее время в эксплуатацию вводятся сложные комплексы ферментер-ЭВМ, обеспечивающие более высокий уровень использования турбидостатного способа непрерывного культивирования.
Как химостатное, так и турбидостатное культивирование имеют большое количество вариантов. Например, тот и другой способы могут осуществляться одностадийно и двустадийно. Одностадийное культивирование означает, что процесс ведется в одной емкости (в одном ферментере), а двухстадийное – в двух последовательных ферментерах.
Одностадийное химостатное культивирование применяется при необходимости воспроизвести любую скорость роста культур, кроме максимальной. Двухстадийное культивирование в двух последовательных ферментерах позволяет обеспечивать культуры максимальной скоростью роста и даже создать условия для ее превышения. Для этого в первом ферментере ведется культивирвание при D< µмах , а во второй подается культура из первого и добавляется свежая питательная среда. При этом во втором ферментере происходит повышение скорости протока вплоть до превышения µмах , а вымывание не происходит, т.к. из первого ферментера непрерывно поступает культура.
Одностадийное турбидостатное культивирование используют для получения максимальной скорости роста. При двухстадийном культивировании можно воспроизвести во втором ферменте вторую фазу роста периодической культуры – вернее фазу роста, связанную с синтезом вторичного продукта метаболизма. В первом ферментере ведется выращивание культуры при большой скорости роста, что соответствует фазе логарифмического роста периодической культуры. Второй ферментер берется большего размера или с содержанием значительно большего количества питательной среды. Поэтому поступающая из первого ферментера культура оказывается в условиях замедленного роста, соответствующего скорости роста периодической культуры в фазу стационарного максимума. Именно эта скорость и является оптимальной для синтеза вторичного продукта.
При низких концентрациях субстрата и при низкой концентрации клеток можно возвратить в ферментер часть вытекающей из него биомассы, возврат повышает концентрацию и ускоряет процесс. Вариантов возврата биомассы может быть несколько. Сепарируют вытекающую культуру и сгущенную часть возвращают в ферментер. Устанавливают различные фильтрующие устройства, позволяющие вытекать культуральной жидкости, но задерживающие клетки. Известны и другие методы культивирования.
Отъемно-доливной метод. Среда подается в проточный ферментер порциями. Отъем культуры также производится порциями или происходит постоянный слив. Кривая концентрации клеток при данном способе приобретает вид гребенки.
Многократное выращивание без стерилизации. Пименяется в практике наращивания патогенных бактерий для получения вакцин или других биопрепаратов. Из ферментера после окончания цикла роста сливается не вся культура, а оставляется небольшая её часть. К ней добавляется стерильная среда и цикл наращивания биомассы повторяется. Так ведут несколько циклов.
Продленная периодическая культура или метод подпитки. К периодической культуре добавляют свежую питательную среду по мере её истощения. Культура продолжает свой быстрый рост, который идет с постоянной скоростью до полного исчерпания всех компонентов питания.
Диализное культивирование. Культивирование ведут в гильзе, не проницаемой для клеток, но пропускающей растворенные вещества. Гильза с культурой помещается в проточную питательную среду. Из среды поступают компоненты питания и в неё же выносятся продукты метаболизма. Таким путем получают сильно концентрируемую биомассу.
Дата публикования: 2015-11-01; Прочитано: 1328 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
