 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Зависимость скорости ферментативных реакций от концентрации субстратов, ферментов, температуры
|
|
А). Зависимость скорости ферментативной реакции от количества ферментов
 При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии.Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов.
При проведении ферментативной реакции в условиях избытка субстрата скорость реакции будет зависеть от концентрации фермента. Графическая зависимость такой реакции имеет вид прямой линии.Однако количество фермента часто невозможно определить в абсолютных величинах, поэтому на практике пользуются условными величинами, характеризующими активность фермента: одна международная единица активности (ME) соответствует такому количеству фермента, которое катализирует превращение 1 мкмоль субстрата за 1 мин при оптимальных условиях проведения ферментативной реакции. Оптимальные условия индивидуальны для каждого фермента и зависят от температуры среды, рН раствора, при отсутствии активаторов и ингибиторов.
Зависимость накопления продукта (А) и убыли субстрата (Б) от времени (продолжительности) протекания реакции. Скорость ферментативной реакции определяется изменением концентрации продукта или субстрата за единицу времени. В реакциях, катализируемых ферментами 1 и 2, начальная скорость реакции, катализируемой ферментом 1, ниже, чем скорость реакции, катализируемой ферментом 2, так как тангенс угла наклона касательной к кривой профиля реакции, проведённой из "О" точки у второго фермента выше, как в случае накопления продукта (А), так и убыли субстрата (Б). Скорость в любой момент времени t определяется тангенсом угла наклона касательной к профилю реакции в момент времени t. Период времени ферментативной реакции [t0 -t1] характеризуется линейным накоплением продукта (или убылью субстрата) в зависимости от длительности реакции. Период ферментативной реакции [t1 - tx] характеризуется нелинейным накоплением продукта (или убылью субстрата) в зависимости от времени реакции.
Количество единиц активности nME определяют по формуле:
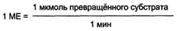
Б). Зависимость скорости ферментативной реакции от температуры среды
Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной
реакции подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой молекулы
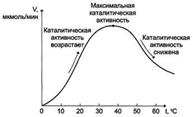 Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).
Для большинства ферментов человека оптимальна температура 37-38 °С. Однако в природе существуют и термостабильные ферменты. Например, Taq-полимераза, выделенная из микроорганизмов, живущих в горячих источниках, не инактивируется при повышении температуры до 95 °С. Этот фермент используют в научно-практической медицине для молекулярной диагностики заболеваний с использованием метода полимеразной цепной реакции (ПЦР).
В). Зависимость скорости ферментативной реакции от количества субстрата
При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Данное состояние соответствует максимальной скорости реакции Vmax.
Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта. Это наблюдение легло в основу ферментативной кинетики, разработанной учёными Л. Михаэлисом и М. Ментен в 1913 г.
Скорость реакции пропорциональна концентрации фермент-субстратного комплекса ES, a скорость образования ES зависит от концентрации субстрата и концентрации свободного фермента. На концентрацию ES влияет скорость формирования и распада ES.
Наибольшая скорость реакции наблюдается в том случае, когда все молекулы фермента находятся в комплексе с субстратом, т.е. в фермент-субстратном комплексе ES, т.е. [Е] = [ES].
Зависимость скорости ферментативной реакции от концентрации субстрата выражается следующим уравнением (математическое выведение этой формулы можно найти в пособиях по ферментативной кинетике):
V = Vmax[S] / Km + [S]
Это уравнение получило название уравнения Михаэлиса-Ментен.
Уравнение Михаэлиса-Ментен - основное уравнение ферментативной кинетики, описывающее зависимость скорости ферментативной реакции от концентрации субстрата.
Если концентрация субстрата значительно больше Km (S >> Km), to увеличение концентрации субстрата на величину Кm практически не влияет на сумму (Km + S) и её можно считать равной концентрации субстрата. Следовательно, скорость реакции становится равной максимальной скорости: V = Vmax. В этих условиях реакция имеет нулевой порядок, т.е. не зависит от концентрации субстрата. Можно сделать вывод, что Vmax - величина постоянная для данной концентрации фермента, не зависящая от концентрации субстрата.
Если концентрация субстрата значительно меньше Km(S << Km), то сумма (Km + S) примерно равна Кm, следовательно, V = Vmax[S]/Km, т.е. в данном случае скорость реакции прямо пропорциональна концентрации субстрата (реакция имеет первый порядок).
Vmах и Km - кинетические характеристики эффективности фермента.
Vmax дает характеристику каталитической активности фермента и имеет размерность скорости ферментативной реакции моль/л, т.е. определяет максимальную возможность образования продукта при данной концентрации фермента и в условиях избытка субстрата. Кm характеризует сродство данного фермента к данному субстрату и является величиной постоянной, не зависящей от концентрации фермента. Чем меньше Кm, тем больше сродство фермента к данному субстрату, тем выше начальная скорость реакции и наоборот, чем больше Кm, тем меньше начальная скорость реакции, тем меньше сродство фермента к субстрату.
Дата публикования: 2015-11-01; Прочитано: 1062 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
