 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Молекулярная стр-ра биолог-й мембраны
|
|
1) Липиды биомембран распол-ны 2 слоями (2хслойная стр-ра). 2) Каждый монослой сост-т из сложных липидов и иногда холестерина, распол-х таким образом, что незаряж-е гидрофобны е хвосты нах-ся в тесном контакте др с др. 3) В таком же контакте нах-ся гидрофильные заряж-е головы. 4) Все взаимодействия носят искл-но нековалентный хар-р. 5) Два монослоя совмещаются, ориентируясь хвост к хвосту, так что обрся стрра двойного слоя, им-щего незаряж-ю (неполярную) гидрофобную внутр-ю часть и 2 заряженные гидрофильные поверхности.
гидрофобная часть
Гидрофильная головка
Мембранные белки. По располож-ю белков в мембране и способу ассоциации с липидным слоем их можно разделить на: 1) поверхн-е или периферич-е мембр-е белки, связ-е с гидрофильной пов-ю липидного бислоя; 2) интегральные, погружённые в гидрофобную область бислоя.
Избират-й транспорт в-в через мембрану:
1)Пассивный тр-рт – осущ-ся без затраты энергии, благодаря: - градиенту концентраций по разные стороны мембраны для незаряж-х частиц; - направлением электрического поля для ионов металлов;
2)Акт-й или энергозавис-й тр-рт – тр-рт в-ва против градиента концентрации, т. е. перенос в-ва в область более выс-х концент-й. Для акт-го тр-рта исп-ся энергия АТФ. Тр-рт осущ-ся с пом-ю мембр-х белков.
Жирные кислоты (ж.к): В природе ≈ 200-500. Широкое распр-е получили не более 20, кот-е хар-ся м общими св-ми: 1) Ж.к., вход-е в состав липидов высших раст-й и жив-х, - это монокарбоновые к-ты, сод-е линейные углеводор-е цепи (С12-С20), общая формула кот-х: CH3(CH2)n-2COOH. 2) Прир-е ж.к. содт чётное число атомов «С». 3) В липидах сод-ся как насыщ-е, так и ненасыщ-е ж.к., с неск-ми ненасыщ-ми св-ми. 4) Все прир-е ненасыщ-е к-ты явл-ся несопряжёнными, т. е. ненасыщ-е связи всегда разделены метиленовой (-CH2-) гр-й. На долю всех ненасыщ-х ж.к., вход-х в состав липидов, прих-ся до 75% всех ж.к. 5) Как правило, прир-е ненасыщ-е ж.к. имеют цис-конф-ю.
Примеры ж.к.: 1) насыщ-е: пальмитиновая - (С16) CH3-(CH2)14-COOH
стеариновая - (С18) CH3-(CH2)18-COOH2). с двумя двойными связями: линолевая - (С18) CH3-(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH. с четырьмя двойными связями: арахидоновая - (С20) CH3-(CH2)4-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-(CH2)5-COOH
Окисление ВЖК.
R-CH2-CH2-COOH→(HSKoA/ АТФ, превращ-е в акт-ю форму при уч-и фермента тиокиназы)→ R-CH2-CH2-COSKoA (ФАД)далее окисление → R-CH=CH-COSKoA (α,β-енолин SKoA) →гидротаза (вода)→ R-CH-CH2-COSKoA (β-гидроксиацилKoA)→(НАД+ /
ОН
НАДН) R-C-CH2-COSKoA(β –кетоацилKoA)→ (НKoA)
║
О
→ R –COSKoA + СН3СОSKoA (β – окисление).
Окисление ВЖК с нечетным количеством:
R-(CH2 )n- COOH → n СН3 –СО-SKoA + СН3- CH2 -СО-SKoA→(-АТФ/ СО2, Н витамин, АТФ) СН3 -СН- СО-SKoA (метилмолонилKoA)→
СООН
(мутаза) KoS- СО -CH2 -CH2 –СООН (сукцинилKoA).
Схема окисления:
Олеиновая кислота
Цис- транс-
100. Монос-ды. Клас-я, стереохимия, таутомерия, хим-е св-ва по гидроксильной/ым и карбонильным гр-пам, специфич-е св-ва. Важнейшие предст-ли монос-в и их биолог-я роль.
Монос-ды предст-ют собой соед-я со смешанными функц-ми. Они сод-т альдегидную или ке-тогруппу и неск-ко гидроксильных групп, т. е. явл-ся альдегидоспиртами или кетоноспиртами. Следов-но, углеводы явл-ся полигидроксикарбонильными соед-ми.
Монос-ды с альдегидной группой наз-ся альдозами, с кетогруппой — кетозами. По числу углеродных атомов в мол-ле монос-ды дел-ся на тетрозы, пентозы, гексозы и т. д..
Альдозы и кетозы с один-м числом атомов углерода изомерны между собой. Наибольшее значение среди монос-в имеют гексозы и пентозы.
Структура моносахаридов. Для изобр-я строения монос-в исп-ют проекционные формулы Фишера. Циклические формы принято изображать перспективными формулами Хеуорса.

Физ-е св-ва: Монос-ды – бесцв-е кристал-е в-ва, сладкие на вкус, хор. раствор-е в воде, нераствхе в эфире, плохо раствхе в спирте. Сладость моносх-в различна. Напр., фруктоза слаще глюкозы в 3 раза.
Хим-е св-ва: Монос-ды — это соед-я со смешанными функц-ми. В раств-х сущ-ет динамич-е равновесие между неск-ми таутомерными формами монос-в, поэтому в зав-сти от усл-й и реагентов они могут реагир-ть в открытой или циклич-й форме. При этом равновесие смещ-ся в сторону образ-я той формы, кот-я вступает во взаимод-е. Химе свва моносахв обуслны налем: а) карбонильной грпы в открытых формах монос-в; б) спиртовых гидроксильных групп как в откр-х, так и в циклич-х формах монос-в; в) полуацетальной гидрокс-й группы в циклич-х формах монос-в.
1. Р-ции с уч-ем альдегидной группы глюкозы (т. е. свойства глюкозы как альдегида).
1. Восстановление (гидрирование) с обр-ем многоат-го спирта:
CH2-(CHOH)4-COH + H2 →Ni CH2-(CHOH)4-CH2OH
2.Окисление: Глюкоза легко окисл-ся. В зав-сти от хар-ра ок-лей получ-ся разл-е прод-ты. 1) Ок-е под действием слабых (мягких) ок-лей с обр-ем глюконовой к-ты. К таким р-циям отн-ся кач-е р-ции на глюкозу как альдегид: р-ция с аммиачным р-ром оксида серебра (I) Ag2O (р-ция «серебряного зеркала») и реакция с Си(ОН)2 в щелочной среде при нагревании:
Глюкоза + Ag2O →NH4OH CH2OH-(CH-OH)4-COOH + 2Ag глюконовая к-та
2) Ок-е под действием сильных ок-лей (напр., HNO3) с обр-ем двухосновной глюкаровой к-ты:
Глюкоза + HNO3 = COOH-(CH-OH)4-COOH глюкаровая кислота
II. Р-цииглюкозы с уч-емгидроксилъных групп (т. е. св-ва глюкозы как многоат-го спирта):
1. Взаимод-е с Си(ОН)2 на холоду с обр-ем глюконата меди (II) (кач-я р-ция на глюкозу как многоат-ый спирт).


2. Взаимод-е с ангидридами или галогенангидрида-ми к-т ( 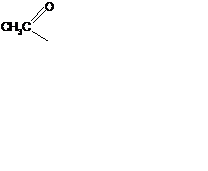 ) с обр-ем сложных эфиров
) с обр-ем сложных эфиров
3. Взаимод-е с галогеналканами с обр-ем простых эфиров:
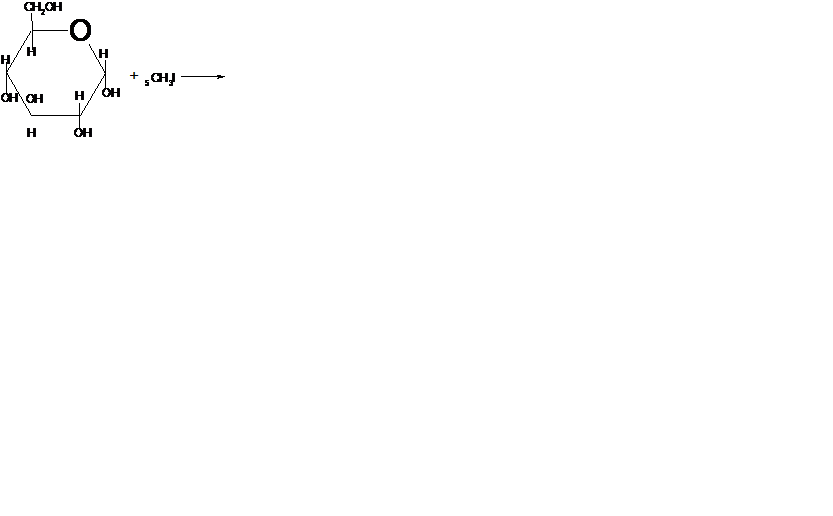

4. Взаимодействие со спиртами с образованием гликозидов/
III. Брожение (ферментация) монос-в: это расщепл-е монос-в под влиянием биолог-х кат-в — ферм-в, вырабат-мых микроорг-ми. Разные микроорг-мы выз-ют разл-е виды брожения. Название вида брожения опр-ся назв-ем образ-хся прод-в брожения. Брожение — сложный многост-й биохим-й процесс. Суммарные уравнения разл-х типов брожения глюкозы.
1. Спиртовое брожение: С6Н12О6 = 2С2Н5ОН + 2СО2
2. Маслянокислое брожение: С6Н12О6 = СН3-СН2-СН2-СООН + 2Н2+ 2СО2
3. Молочнокислое брожение: C6H12O6 = ферменты= 2 СH3-CHOH-COOH
4. Лимоннокислое брожение:C6H12O6 +3[O]=ферменты= HOOC-CH2-COHCOOH-COOH + 2H2O
Дата публикования: 2015-11-01; Прочитано: 347 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
