 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Конверсия метана
|
|
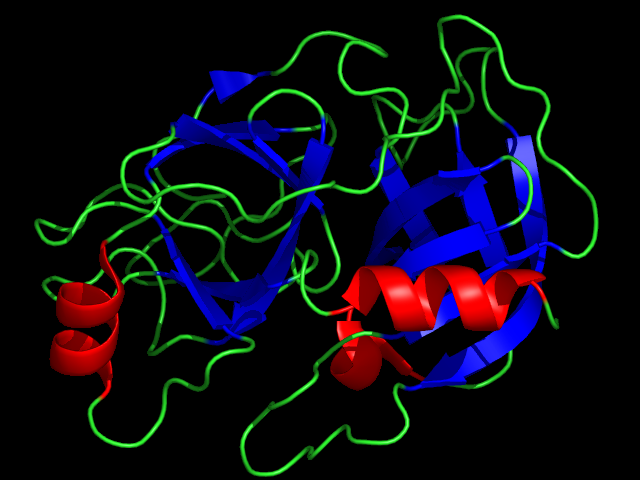
Рис. 1. На картинке представлена доменная структура альдегидоксидоредуктазы.
Молекула это фермента представляет собой димер, состоящий из двух симметрично расположенных идентичных полипептидных цепей (гомодимер).
Домены выражены не только у ферментов, связывающих добавочные (небелковые) группы, но и у простых ферментов – протеинов.
Третичная структура белка- это расположение в пространстве всех атомов белковой молекулы. Для формирования третичной структуры белка важнейшее значение имеют различные виды связей, возникающие между радикалами определенным образом расположенных аминокислотных остатков в полипептидной цепи белка. Это в основном слабые взаимодействия: водородных связей, ионных и гидрофобных взаимодействий. В ряде случаев третичная структура дополнительно поддерживается ковалентными связями.
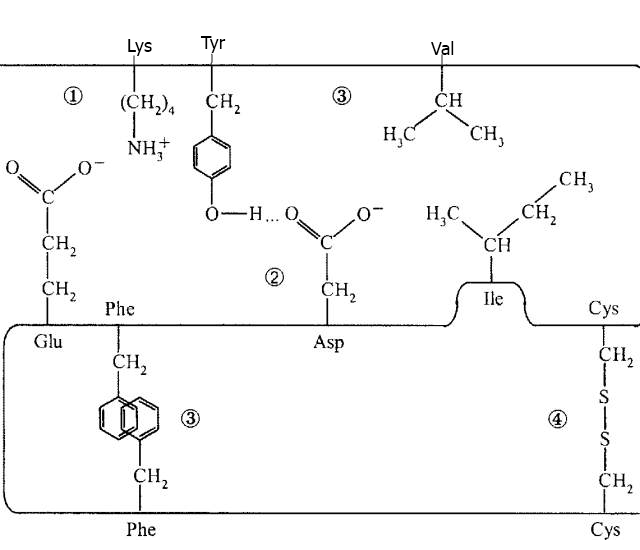
Рис.2. Связи, стабилизирующие третичную структуру белка.
1 – ионные, 2-водородные, 3-гидрофобные, 4-ковалентные.
Формирование пространственной структуры белка в животной клетки представляет собой непростую систему взаимодействия вновь образующейся в процессе трансляции белковой молекулы с существующими в клетке белками. Процесс формирования пространственной структуры белка – фолдинг - обозначает образование определенных складок, изгибов в полипептидной цепи, т.е. процесс становления третичной структуры белка, структур с определенным набором и топологией расположения элементов вторичной структуры.
| Источник | Белки, подвергающиеся фолдингу | Шаперон | Функция |
| E.coli | Предшественники секреторных белков; ДНК-репликационный комплекс | GroEL SecB DanK | Задержка свертывания перед транспортом; реорганизация белкового комплекса. |
| Фотосинтезирующие бактерии | Рибулозо-1,5-бисфосфаткарбоксилаза | GroEL | Сборка олигомера |
| хлоропласты | Рибулозо-1,5-бисфосфаткарбоксилаза | RuSBR | Сборка олигомера |
| митохондрии | Митохондриальные белки; белки предшественники в матриксе | Hsp70 Hsp60 | Завершение транслоккации; стабилизация не полностью свернутых структур в матриксе. |
| ЭПР | Секреторные белки | Bip TRAP B70 | Завершение транслоккации; стабилизация не полностью свернутых структур в матриксе. |
| Цитозоль | Синтезируемые полипептиды Митохондриальные секреторные белки | Hsc70 Hsp90 | Разворачивание перед трансляцией стабилизация не полностью свернутых структур |
| Ядро | Гистоны | Нуклеоплазмин | Сборка нуклеосом. |
Шапероны представляют собой белковые комплексы, встречающиеся в бактериях, цитоплазме, митохондриях и в хлоропластах. Они способствуют корректному сворачиванию синтезируемых полипептидных цепей, защищают свернутые в пространстве глобулы цепи от агрегации.
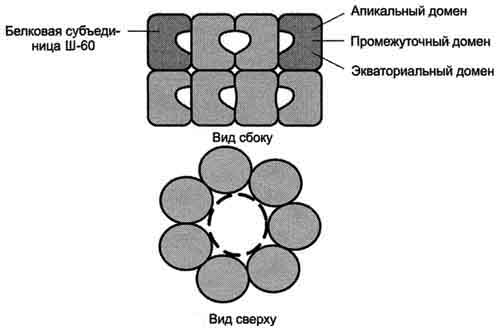
Рис.3.Структура шаперонового компонента.
темное кольцо в центре-участки связывания полипептида.
Четвертичная структура характерна для белков, построенных из нескольких полипептидных цепей. Она представляет собой способ взаимного расположения в пространстве отдельных полипептидных цепей в молекуле белка, необходимый для проявления специфических функций. Отдельные полипептидные цепи, входящие в состав белков, обладающих четвертичной структурой, называются протомеры или субъединицы, из которых формируется эпимолекула такого белка-мультимера.
Четвертичная структура поддерживается в основном силами слабых взаимодействий, поэтому она представляет собой достаточно лабильное образование, значительно менее прочное чем третичная и тем более вторичная структура.
Белки, обладающие четвертичной структурой, как правило, содержат четное число субъединиц и представляют собой димеры, тетрамеры, гексамеры, октамеры и т.д. Четно число субъединиц, очевидно, отображает общий принцип симметрии, свойственный живой природе. Белки с нечетным числом субъединиц – относительно редкое явление, и часть из них выполняют очень важные и своеобразные функции у многих организмов. Так тримерами являются некоторые из GTP-связывающих белков(G-белки). Их основная функция состоит в передачи сигналов внутрь клетки или различных ее компартментах, хотя часть из них выполняют и иные функции. G-белки обладают способностью гидролизировать GTP(Гуанозинтрифосфат) до GDP(Гуанозиндифосфат) и фосфора, переходя из активного состояния в неактивное состояние. GTPазная активность G-белков приводит к высвобождению энергии макроэргических связей GTP, которая используется для передачи энергии.
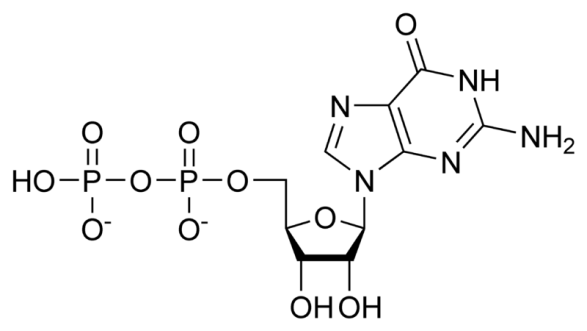
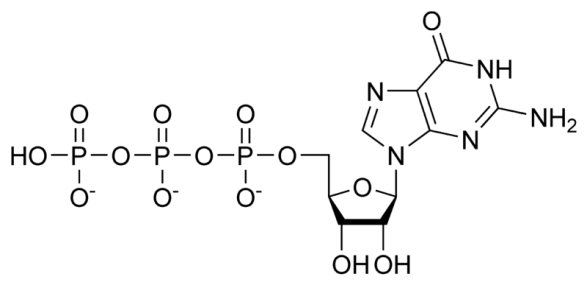
Рис.4. Гуанозиндифосфат Рис.5. Гуанозинтрифосфат
Сходное строение имеют Gs и Gi – компоненты широко распространенные в живых системах аденилакциклазной системах, участвующие, в частности, в передачи гормональных сигналов внутрь клеток-мишеней. Эти белки способны принимать сигналы от белка-рецептора и передавать его аденилатциклазе - ферменту, осуществляющему синтез сAMP- вторичного мессенджира, который в свою очередь регулирует активность целого ряда внутриклеточных ферментов и соответствующих биохимических процессов. Белки Gs и Gi, как и трансдуцин, представляют собой тримеры, состоящие из различных субъединиц (α, β, γ). Gs и Gi называют соответственно стимулирующим и ингибирующим белками, способными альтернативно влиять на активность аденилатциклазы. У Gs- белка субъединица α способна связывать и гидролизировать GTP, что ведет к изменению конформации G-белка и аденилатциклазы, которая переходит в активное состояние(рис.6). Комплекс субъединиц α, GDP, субъединицы β и γ представляет собой неактивную форму белка. Замещение GDP на GTP в этом комплексе резко убыстряется под действием стимулирующего рецептора Rs расположенного в мембране.
Пространственная структура тримера Gi – белка представлена на рисунке 7. Так же приведены структуры других белков: GTP-связывающего фактора элонгации трансляции EF-T бактерий и белка Ras, участвующего в полиферакции клеток млекопитающего.
В состав белков с четным числом субъединиц могут содержаться идентичные или различные по структуре протомеры. Например фермент альдоза состоит из четырех одинаковых субъединиц, а гемоглобин содержит в своем составе две пары разных субъединиц: две субъединицы типа α и две субъединицы типа β. Таким образом четвертичная структура отвечает формуле 2α2β. В обоих вышеотмеченных примерах тетрамерных белков их протомеры пространственно расположены в вершинах тетраэдра (рис.8). Димерами, состоящими из субъединиц одного вида, являются альдегидоксидоредуктаза(см. рис.1) и эндонуклаза рестрикции.
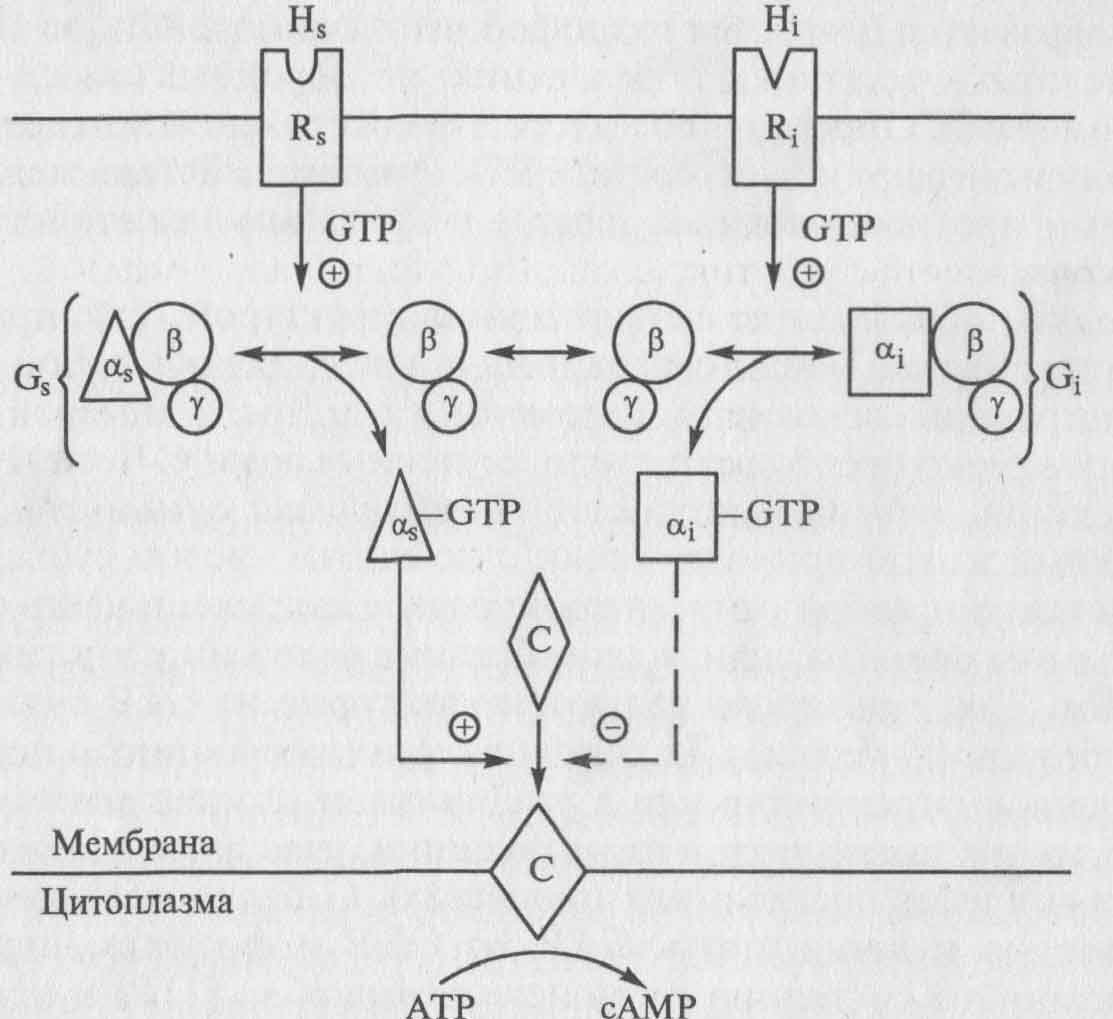
Рис.6. Схема участия G-белков в передаче сигнала аденилатциклазе.
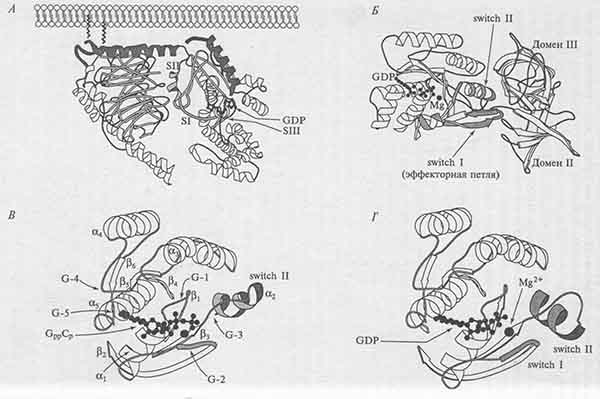
Рис.7. строение G-белков. А-гетиротример белка Gi. связанный с плазматической мембраной. Б- структура фактора элонгации трансляции. В, Г – структура белка Ras.
Рестриктаза представляет собой димер и связывается с ДНК, находящейся в B-форме. После связывания с ДНК молекула этого фермента претерпевает ряд конформационных изменений, в результате которых отдельные участки полипептидных цепей каждой из субъединиц образуют своеобразные структуры, “рукава”, которые служат для плотного контакта с ДНК(рис.9). “Рука” одной субъединицы входит в малую борозду ДНК, а “рука”
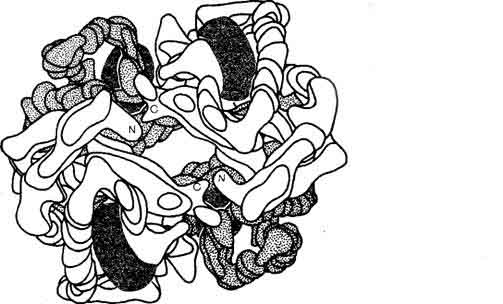
Рис.8. Модель четвертичной структуры гемоглобина.
другой субъединицы взаимодействует с сахорофосфатным остовом на другой стороне двойной стороне двойной спирали ДНК.
От четвертичной структуры стоит отличать олигомерно состояние белков. Многие белки обладают способностью образовывать структуры с изменяющимся в определенной пропорции числом полипептидных цепей. Не обладают, по существу, четвертичными структурами белковые молекулы возникшие в результате расщепления белков-предшественников. Примерами таких белков может служить химотрипсин и инсулин. Молекула инсулина состоит из двух полипептидных цепей – А и В, содержавших соответственно 21 и 30 аминокислотных остатков. Эти цепи образуют единую с дисульфидными связями, которая получается после вырезания из проинсулина связующего пептида С, в результате чего инсулин приобретает свойственные ему гормональные функции: 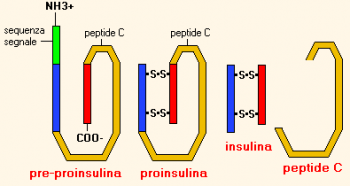
К четвертичной структуре не стоит относить надмолекулярные белковые и ферментные комплексы – мультиэнзимные комплексы и метаболоны. Образование таких структур связано с необходимостью поддержания высоких скоростей метаболических процессов в живой клетке.
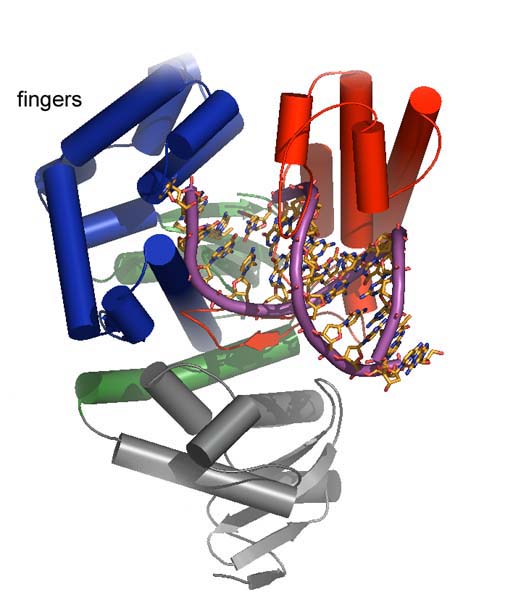
Рис.9. структура рестриктазы.
Среди такого рода полиферментных комплексов можно различать абсорбционные и интегральные ансамбли ферментов. Абсорбционные ансамбли образуются за счет слабых взаимодействий между молекулами ферментов на поверхности мембраны либо какой-то крупной центральной молекулы. Интегральные комплексы оказываются встроены в внутриклеточные мембраны. К адсорбционным комплексам относятся полиферментный комплекс окислительного декарбоксилирования пировиноградной кислоты (ПВК), состоящий из трех ферментов, каждый из которых в этом комплексе представлен определенным числом молекул.
Одним из видов полиферментных комплексов являются протеасомы. Это крупные, имеющие определенный план строения комплексы протеолитических ферментов, расщепляющие различные внутриклеточные белки. Они обнаружены у самых различных организмов и представляют собой существенный компонент АТР-зависимого протеолиза, входе которого осуществляется исключительно быстрая дегидратация прежде всего аномальных белков. В составе некоторых протеасом выявлены РНК, состоящие из 80 нуклеотидных остатков. Протеасомы содержаться в цитоплазме и ядрах клеток, а также в эндоплазматическом ретикулуме. Однако их содержание велико в эндоплазматическом матриксе ~ 50%.
Отдельные протеасомы обладают различной специфичностью в отношении пептидных связей расщепляемых ими белков, что способствует быстрой деструктуризации последних в полости протеасом. В составе протеасом имеются трипсинподобные и химотрепсинподобные протеиназы. Механизм расщепления белков протеасомами связан с действием особого внутриклеточного белка- убиквитина(рис.10).
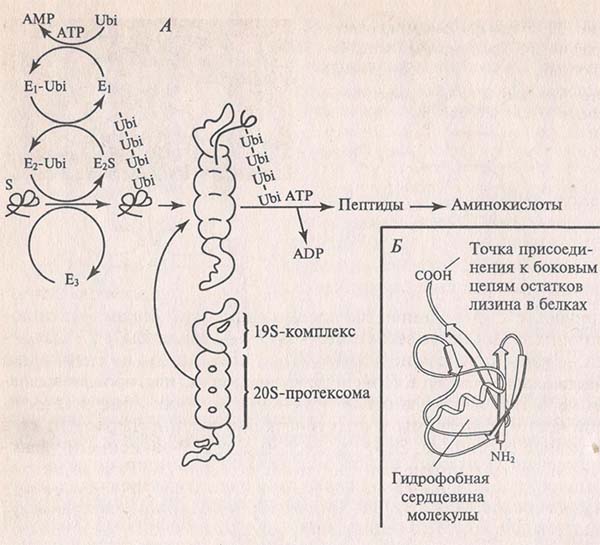
Рис.10. АТР-зависимый механизм деструктуризации белка(S) с участием убиквитина и протеасомы.
А-схема процессов с участием ферментов, осуществляющих полиубиквитирование белка; Б-структура убиквитина; Ubi-убиквитин.
| Заканчивая рассмотрение структур белков, отметим кратко некоторые аспекты их структурно функциональной эволюции. Принцип усложнения жизненных форм в процессе биологической эволюции оказывается в целом вполне применим к эволюции белков. Большинство современных белков состоит из нескольких сотен аминокислотных остатков, но вместе с этим в природе существуют и белки из нескольких аминокислотных остатков. Главенствующий и, очевидно, сложившийся на первых этапах эволюции матричный принцип биосинтеза белков позволяет считать, что более протяженные полипептиды появились в результате наращивания или слияния более коротких генов. |
Словарь применяемых терминов.
GTP (Гуанозинтрифосфат)— это пуриновый нуклеотид.
GDP (Гуанозиндифосфат)- нуклеотид, эфир пирофосфорной кислоты с гуаниловым нуклеозидом. ГДФ состоит из пирофосфата, сахара пентозы рибозы и азотистого основания гуанина.
ГДФ — продукт дефосфорилирования ГТФ ГТФазами, например, в реакциях передачи сигнала G-белками
G-Белки -это семейство белков, относящихся к ГТФазам и функционирующих в качестве вторичных посредников во внутриклеточных сигнальных каскадах. G-белки названы так, поскольку в своём сигнальном механизме они используют замену GDP на GTP как молекулярный функциональный «выключатель» для регулировки клеточных процессов.
Аденилатциклаза -катализирует превращение АТФ в 3',5'-цАМФ с образованием пирофосфата.
В процессе передачи сигнала аденилатциклаза может быть активирована связанными с плазматической мембраной рецепторами, связанными с G-белками, которые передают гормональные и иные стимулы в клетку. Активация аденилатциклазы приводит к образованию цАМФ, действующего как вторичный посредник. цАМФ взаимодействует с протеинкиназой А, ионными каналами, связанными с циклическими нуклеотидами, и регулирует их функции.
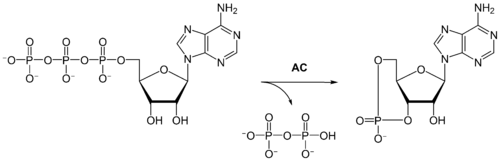
Фермент аденилатциклаза катализирует превращение АТР в 3',5'-циклическую форму АМФ. При этом образуется пирофосфат.
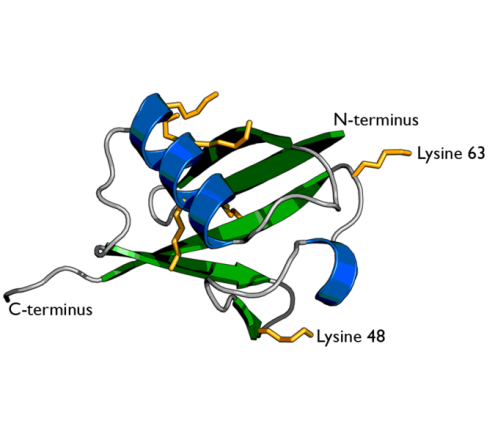
Убиквити́н - небольшой консервативный белок, который у эукариот присоединяется к белкам. Убиквитинирование — это посттрансляционное присоединение ферментами убиквитин-лигазами одного или нескольких мономеров убиквитина с помощью ковалентной связи к боковым аминогруппам белка-мишени. Присоединение убиквитина влияет на внутриклеточную локализацию и функцию белков. Самым первым открытием стала деградация белков, помеченных мультиубиквитиновыми цепями, с помощью 26S- протеасомы. Однако система убиквитина вовлечена и в такие важные процессы, как пролиферация, развитие и дифференцировка клеток, реакция на стресс и патогены, репарация ДНК.
Убиквин:
Трипсин - фермент класса гидролаз, расщепляющий пептиды и белки; обладает также эстеразной (гидролиз сложных эфиров) активностью.
Трипсин синтезируется в поджелудочной железе в виде неактивного предшественника (профермента) трипсиногена. Трипсины ряда животных получены в кристаллическом виде (впервые в 1932). Молекула бычьего трипсина (молекулярная масса около 24 кДа) состоит из 223 аминокислотных остатков, образующих одну полипептидную цепь, и содержит 6 дисульфидных связей. Изоэлектрическая точка трипсина лежит при pH 10,8, а оптимум каталитической активности — при pH 7,8—8,0.
Трипсины относятся к группе сериновых протеаз и содержат в активном центре остатки серина и гистидина. Трипсины легко подвергаются самоперевариванию (аутолизу), что приводит к загрязнению препаратов трипсинов неактивными продуктами (промышленный препарат содержит до 50 % неактивных примесей). Препараты трипсина высокой чистоты получают хроматографическими методами.
Протеолиз — процесс ферментативного разложения белков, катализирующийся протеолитическими ферментами (протеазами).
протеолитические ферменты — ферменты из класса гидролаз, которые расщепляют пептидную связь между аминокислотами в белках.
*Фибриллярные белки — белки, имеющие вытянутую нитевидную структуру, в которой отношение длинной оси молекулы к короткой (степень асимметрии) составляет от 80 до 150.
Глава№2
Во второй главе я расскажу про органические и неорганические соединения, которые могли встречаться во время формирования земли и первичного бульона. Это как правило самые простейшие из своего класса, которые при взаимодействии с другими веществами образовывали новые вещества.
В этой главе мы рассмотрим химические свойства веществ, с чем они реагируют и что является продуктом реакции.
Органическая химия.
Алканы.
Алканы - ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2.
Химические свойства.
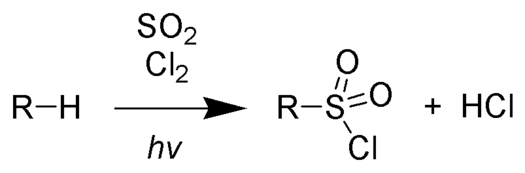
Сульфохлорирование
При облучении УФ-излучением алканы реагируют со смесью SO2 и Cl2, После того, как с уходом хлороводорода образуется алкильный радикал, присоединяется диоксид серы. Образовавшийся сложный радикал стабилизируется захватом атома хлора с разрушением очередной молекулы последнего.
Реакции окисления:
- Горение
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример:
CH4 + 2O2 → CO2 + 2H2O + Q.
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
С n Н2 n +2 +(1,5 n +0,5)O2 → n CO2 + (n +1)H2O.
- Каталитическое окисление
Могут образовываться спирты, альдегиды, карбоновые кислоты.
При мягком окислении СН4 в присутствии катализатора кислородом при 200 °C могут образоваться:
метанол: 2СН4 + О2 → 2СН3ОН;
формальдегид: СН4 + О2 → СН2О + Н2O;
муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O.
Окисление также может осуществляться воздухом. Процесс проводится в жидкой или газообразной фазе. В промышленности так получают высшие жирные спирты и соответствующие кислоты.
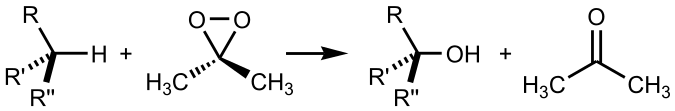
Ниже представлена реакция окисления алканов диметилдиоксираном:
Термические превращения алканов:
- Разложение
Реакции разложения происходят лишь под влиянием больших температур. Повышение температуры приводит к разрыву углеродной связи и образованию свободных радикалов.
Примеры:
CH4 → C + 2H2 (t > 1000 °C).
C2H6 → 2C + 3H2.
- Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
В 1930—1950 гг. пиролиз высших алканов использовался в промышленности для получения сложной смеси алканов и алкенов, содержащих от пяти до десяти атомов углерода. Он получил название «термический крекинг». С помощью термического крекинга удавалось увеличить количество бензиновой фракции за счёт расщепления алканов, содержащихся в керосиновой фракции (10—15 атомов углерода в углеродном скелете) и фракции солярового масла (12—20 атомов углерода). Однако октановое число бензина, полученного при термическом крекинге, не превышает 65, что не удовлетворяет требованиям условий эксплуатации современных двигателей внутреннего сгорания.
В настоящее время термический крекинг полностью вытеснен в промышленности каталитическим крекингом, который проводят в газовой фазе при более низких температурах — 400—450 °C и низком давлении — 10—15 атм на алюмосиликатном катализаторе, который непрерывно регенерируется сжиганием образующегося на нём кокса в токе воздуха. При каталитическом крекинге в полученном бензине резко возрастает содержание алканов с разветвлённой структурой.
Для метана:
2CH4 → C2H2 + 3H2 — при 1500 °C.
Частичный крекинг:
CH4 → С + 2H2— при 1000 °C.
- Дегидрирование
Образование:
1) В углеродном скелете 2 (этан) или 3 (пропан) атома углерода — получение (терминальных) алкенов, так как других в данном случае не может получиться; выделение водорода:
Условия протекания: 400—600 °C, катализаторы — Pt, Ni, Al2O3, Cr2O3.
а) CH3-CH3 → CH2=CH2 + H2 (этан → этен);
б) CH3-CH2-CH3 → CH2=CH-CH3 + H2 (пропан → пропен).
2) В углеродном скелете 4 (бутан, изобутан) или 5 (пентан, 2-метилбутан, неопентан) атомов углерода — получение алкадиенов; выделение водорода:
в) CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (бутан → бутадиен-1,3 — дегидрирование удалённых связей С—С).
в') CH3-CH2-CH2-CH3 → CH2=C=CH-CH3 + 2H2 (бутан → бутадиен-1,2 — дегидрирование соседних связей С—С—С).
3) В углеродном скелете 6 (гексан) и более атомов углерода — получение бензола и его производных:
г) CH3-CH2-CH2-CH2CH2-CH2-CH2-CH3 (октан) → П.-ксилол, параллельно М.-ксилол, параллельно этилбензол + 4H2.
Конверсия метана
В присутствии никелевого катализатора протекает реакция:
CH4 + H2O → CO + 3H2.
Продукт этой реакции (смесь CO и H2) называется «синтез-газом».
Алкены.
Алкены- ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4).
Химические свойства
Они определяются наличием в алкенах двойной связью. Электронная плотность π-связи достаточно подвижна и легко вступает в реакцию с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения.
Алкены химически активны. Их химические свойства во многом определяются наличием двойной связи. Для алкенов наиболее характерны реакции электрофильного присоединения и реакции радикального присоединения. Реакции нуклеофильного присоединения обычно требуют наличие сильного нуклеофила и для алкенов не типичны.
Особенностью алкенов являются также реакции циклоприсоединения и метатезиса.
Алкены легко вступают в реакции окисления, гидрируются сильными восстановителями или водородом под действием катализаторов до алканов, а также способны к аллильному радикальному замещению.
Дата публикования: 2015-11-01; Прочитано: 833 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
