 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Рівновага утворення комплексів молекул у розчині
|
|
Лекція № 1. ФІЗИКО-ХІМІЧНІ ОСНОВИ МОЛЕКУЛЯРНОЇ БІОЛОГІЇ
1. Енергетика взаємодії між атомами й молекулами.
1.1. Вільна енергія.
1.2. Рівновага утворення комплексів молекул у розчині.
2. Ковалентний зв’язок між атомами в молекулах.
2.1. Властивості ковалентного зв’язку.
2.2. Механізм гнучкості полімерного ланцюга.
2.3. Перебудови системи ковалентних зв’язків у хімічних реакціях.
3. Нековалентні взаємодії між атомами й молекулами.
3.1. Вандерваальсові взаємодії.
3.2. Електростатичні (іонні) взаємодії.
3.3. Водневий зв’язок.
3.4. Гідрофобні взаємодії.
Незважаючи на високу складність живих систем, в основі їхнього функціонування лежать такі самі закони фізики, які виконуються для неживої природи – і жодних інших.
Сьогодні таке твердження може здаватися банальним, однак саме воно є базовим для сучасної парадигми молекулярної біології.
Енергетика взаємодії між атомами й молекулами
Вільна енергія
Розглянемо спрощену модель полімерного ланцюга: мономерні елементи, зображені як червоні кульки на рис. 1, що з’єднані гнучкими перемичками. Нехай мономери при цьому є інертними – не здатними до взаємодій між собою. Просторова форма – конформація – такого ланцюга буде визначатися лише конфігурацією перемичок. У наслідок теплового руху ланцюг буде постійно змінювати свою конформацію, тобто буде реалізована так звана форма невпорядкованого клубка.
На рис. 1 цей стан невпорядкованого клубка зображено як стан 1ліворуч (представлено кілька з великої кількості W1 можливих конформацій ланцюга). Певний компактний стан 2 (праворуч) може бути реалізований значно меншою кількістю W2 конформацій перемичок. Відношення ймовірності f2 знайти ланцюг у стані 2 до ймовірності f1 стану 1 (константа рівноваги K між станами 2 і 1), очевидно, визначається відношенням кількості відповідних конформацій:

Оскільки W2 << W1, то рівновага зсунута ліворуч – у бік клубка. Отже, за інших однакових умов, імовірність знайти будь-яку систему в певному стані визначається кількістю мікростанів (конфігурацій системи), якими цей стан реалізується. Чим більша кількість мікростанів (у нашому прикладі W1 та W2), тим менш упорядкованим є даний стан системи: зрозуміло, що ступінь упорядкованості значно зростає для стану 2.

Рис. 1. Клубок (1) і компактний стан (2) полімерного ланцюга.
Нехай тепер мономери здатні взаємодіяти таким чином, що при утворенні контакту між ними в навколишнє середовище виділяється тепло (знижується внутрішня енергія нашої системи). Як відомо з термодинаміки, усі процеси за інших однакових умов відбуваються в напрямку виділення тепла. Ймовірність певного стану системи визначається відношенням ентальпії H (величина, яка за умов постійного тиску та об’єму є еквівалентною внутрішній енергії системи) до середньої кінетичної енергії теплового руху kBT (kB – константа Больцмана (Ludwig Boltzmann), Т – абсолютна температура). А саме, ймовірність є пропорційною до величини exp 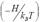 : менше значення ентальпії відповідає зростанню ймовірності (принцип Больцмана). Якщо зниження ентальпії при компактизації ланцюга є значним, то це може змінити конформаційну рівновагу на користь стану 2. Таким чином, у загальному вигляді маємо тепер записати:
: менше значення ентальпії відповідає зростанню ймовірності (принцип Больцмана). Якщо зниження ентальпії при компактизації ланцюга є значним, то це може змінити конформаційну рівновагу на користь стану 2. Таким чином, у загальному вигляді маємо тепер записати:
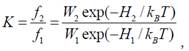
або, позначивши S = kBln W і G = H – TS,
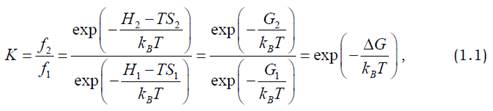
де ΔG = G2 – G1.
Останнє дуже важливе співвідношення має універсальне значення.
У рівнянні (1.1) величина S, що залежить від кількості мікростанів, є мірою невпорядкованості системи й називається ентропією.
G = H −TS, (1.2)
Величина, яка була введена фундатором термодинаміки Гіббсом (Josiah Willard Gibbs), називається вільною енергією. Саме вона в загальному випадку визначає ймовірність перебування системи в певному стані й, відповідно, напрямок, у якому відбувається той чи інший процес. Наступні твердження, що базуються на рівняннях (1.1), (1.2), виконуються для будь-яких систем, у тому числі (і повною мірою) для біологічних та молекулярно-біологічних:
• Зміна стану системи відбувається в напрямку зниження вільної енергії, або: процес може відбуватися тільки тоді, коли він супроводжується зниженням вільної енергії.
• Рівноважний стан, що може бути стабільним скільки завгодно довго, відповідає мінімуму вільної енергії.
• Зміна вільної енергії залежить від двох складових: зміни ентальпії (внутрішньої енергії), яка супроводжується виділенням / поглинанням тепла; зміни ентропії, що характеризує зростання впорядкованості / невпорядкованості в системі.
При цьому величина ентропійного внеску зростає з температурою (рівняння (1.2)), тобто за високих температур переважними завжди стають менш упорядковані стани.
Слід зробити також кілька інших важливих зауважень:
• Вільна енергія є величиною відносною: має сенс тільки різниця між вільними енергіями різних станів тієї самої системи.
• Різниця між вільними енергіями двох станів системи вказує тільки на напрямок перетворення одного стану в інший і нічого не говорить про те, наскільки швидко та яким шляхом буде відбуватися цей процес. Інакше кажучи, стан із меншою величиною вільної енергії неодмінно має бути реалізованим, але може виявитися, що на це потрібно дуже багато часу, і тому практично даний процес не спостерігається.
• Енергія взаємодії між елементами системи (атомами, молекулами) не обов’язково залежить тільки від ентальпійної складової, як у простому прикладі, що його ілюструє рис. 1. Насправді, як буде показано нижче, вільна енергія взаємодій може мати суттєву ентропійну складову або навіть залежати тільки від ентропійних ефектів.
Рівновага утворення комплексів молекул у розчині
Перш ніж перейти до розгляду типів взаємодій між атомамий молекулами, розглянемо ще один приклад рівноваги у простій, але важливій для молекулярної біології системі.
У розчині певного об’єму містяться молекули двох типів (А і В), які здатні утворити між собою комплекс С (рис. 2):

(літерою K тут знову позначено константу рівноваги, у цьому випадку – для процесу утворення / дисоціації комплексів). Ентропійна частина вільної енергії кожного компонента містить складову, яка залежить від концентрації. Наприклад, вільну енергію GA компонента А (що її в цьому випадку називають також хімічним потенціалом) можна записати як

де 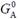 – стандартна вільна енергія; R – універсальна газова стала, яка є константою Больцмана в перерахунку на моль речовини: R = kBTNAV, NAV – число Авогадро (Amedeo Avogadro); квадратними дужками позначено молярну концентрацію А. Зміст рівняння (1.4) дуже простий:
– стандартна вільна енергія; R – універсальна газова стала, яка є константою Больцмана в перерахунку на моль речовини: R = kBTNAV, NAV – число Авогадро (Amedeo Avogadro); квадратними дужками позначено молярну концентрацію А. Зміст рівняння (1.4) дуже простий:  є вільною енергією компонента А при його концентрації 1 моль/л; зростання концентрації призводить до зниження ентропії (чим більше молекул, тим менше доступних місць розташування для кожної з них, тобто тим меншим є кількість мікростанів, див. наведене вище визначення ентропії) і, відповідно, – до зростання вільної енергії.
є вільною енергією компонента А при його концентрації 1 моль/л; зростання концентрації призводить до зниження ентропії (чим більше молекул, тим менше доступних місць розташування для кожної з них, тобто тим меншим є кількість мікростанів, див. наведене вище визначення ентропії) і, відповідно, – до зростання вільної енергії.
Рис. 2. Взаємодія між молекулами А і В з утворенням комплексу С.
Записавши аналогічні вирази для компонентів В і С, знайдемо різницю між правою та лівою частинами рівняння (1.3) ΔG = GC – GA – GB:

де ΔG0 – різниця між відповідними стандартними вільними енергіями, [A] і [B] – концентрації відповідних вільних компонентів у дисоційованому стані. Процес зміни концентрацій у системі буде продовжуватись до моменту досягнення рівноваги – такого співвідношення між концентраціями, коли вільна енергія комплексу дорівнюватиме сумарній енергії вільних компонентів А і В, і ΔG = 0. (Можна показати, що загальна вільна енергія розчину буде мінімальною, коли різниця ΔG між правою і лівою частинами рівняння (1.3) дорівнює нулю.).
Оскільки ΔG0 – це константа, яка залежить від природи компонентів, співвідношення концентрацій під логарифмом у рівнянні (1.5) також є константним за рівноважних умов. Саме це співвідношення і є в даному прикладі константою рівноваги, яка залежить тільки від різниці стандартних вільних енергій:

Отже, якщо при утворенні комплексу вільна енергія знижується(ΔG0 < 0), це сприяє взаємодії між компонентами. У випадку, що розглядається, константу K називають також константою асоціації, або константою зв’язування, а величину ΔG0 – стандартною вільною енергією зв’язування. Обидві константні величини є мірою спорідненості компонентів, що утворюють комплекс: чим негативнішою є енергія зв’язування (чим більше енергетично вигідних взаємодій реалізується між компонентами), тим вище значення K і тим стабільнішим є комплекс. Слід також зауважити, що ефективність утворення комплексу,під якою можна розуміти, наприклад, частку компонента А у складі комплексу – [C]/([C]+[A]), залежить від концентрації компонентів. Рівняння 1.6 є однією з форм запису відомого закону діючих мас, або принципу Ле Шательє (Henry Le Chatelier), згідно з яким додавання в систему одного з компонентів зсуває рівновагу в протилежний бік. Рівняння 1.3 може означати також рівняння хімічної реакції, коли внаслідок перебудови ковалентних зв’язків (див. нижче) у молекулах А і В, утворюється нова молекула С. Тоді рівняння (1.4) – (1.6) і висновки з них також зберігають свою силу. У цьому випадку також знак зміни стандартної вільної енергії вказує на напрямок, у якому відбувається хімічна реакція.
Варто підкреслити ще раз: усі хімічні реакції в живих системах відбуваються в напрямку зниження вільної енергії. Тут може виникнути запитання: якщо, наприклад, вільна енергія знижується при руйнуванні молекули С на А і В, але клітина має потребу саме в молекулі С, чи можливий синтез С? Відповідь є однозначною: синтез С із молекул А і В є неможливим. Але можна використати обхідний шлях: спочатку хімічно модифікувати одну з молекул (наприклад, утворити молекулу А′) і тоді може виявитися, що утворення С із А′ і В супроводжується зниженням вільної енергії, тобто є можливим.
Дата публикования: 2015-11-01; Прочитано: 423 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
