 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Постоянная Авогадро
|
|
Чтобы определить плотность вещества, надо массу тела разделить на его объем.
Следовательно, плотность есть физическая величина, равная отношению массы тела к его объему. Коротко определение запишется так: плотность = масса/ объем.
Введем обозначения: ρ– плотность вещества (греческая буква, читается «ро»), m –масса тела, V- его объем. Тогда получим формулу для вычисления плотности:
M/V
Удельный вес, или плотность вещества, представляет собой соотношение веса тела и занимаемого им объёма
Плотность есть удельная масса вещества, зависящая функционально от массы тела и его объёма.
Лабораторная работа
Плотность воздуха - это количество воздуха, содержащегося в 1 м3 объема. В физике существует понятие двух видов плотности - весовая (удельный вес) и массовая. В аэродинамике чаще всего пользуются массовой плотностью. Весовая плотность (удельный вес) воздуха - это вес воздуха в объеме 1 м3. Обозначается буквой g.
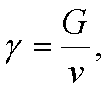
где g - удельный вес, кгс/м3;
G - вес воздуха, кгс;
v - объем воздуха, м3.
Вес, или точнее масса, водяного пара, содержащегося в 1 м3 воздуха, называется абсолютной влажностью воздуха. Другими словами, это плотность водяного пара в воздухе. При одной и той же температуре воздух может поглотить вполне определенное количество водяного пара и достичь состояния полного насыщения. Абсолютная влажность воздуха в состоянии его насыщения носит название влагоемкости. Величина влагоемкости воздуха резко возрастает с увеличением его температуры. Отношение величины абсолютной влажности воздуха при данной температуре к величине его влагоемкости при той же температуре называется относительной влажностью воздуха. Для определения температуры и относительной влажности воздуха пользуются специальным прибором — психрометром.
Абсолютная влажность воздуха (f) — это количество водяного пара, фактически содержащегося в 1м3 воздуха:
f = m (масса содержащегося в воздухе водяного пара)/ V (объём влажного воздуха)
Обычно используемая единица абсолютной влажности: (f) = г/м3
Относительная влажность
Относительная влажность: φ = (абсолютная влажность)/(максимальная влажность)
Относительная влажность обычно выражается в процентах. Эти величины связаны между собой следующим отношением:
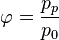
Лабораторная работа
Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц химических веществ.
В основе молекулярно-кинетической теории лежат три основных положения:
1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Наиболее ярким экспериментальным подтверждением представлений молекулярно-кинетической теории о беспорядочном движении атомов и молекул является броуновское движение. Это тепловое движение мельчайших микроскопических частиц, взвешенных в жидкости или газе. Оно было открыто английским ботаником Р. Броуном в 1827 г. Броуновские частицы движутся под влиянием беспорядочных ударов молекул. Из-за хаотического теплового движения молекул эти удары никогда не уравновешивают друг друга. В результате скорость броуновской частицы беспорядочно меняется по модулю и направлению, а ее траектория представляет собой сложную зигзагообразную кривую (рис. 3.1.1). Теория броуновского движения была создана А. Эйнштейном в 1905 г. Экспериментально теория Эйнштейна была подтверждена в опытах французского физика Ж. Перрена, проведенных в 1908–1911 гг.
Главный вывод теории А. Эйнштейна состоит в том, что квадрат смещения < r 2> броуновской частицы от начального положения, усредненный по многим броуновским частицам, пропорционален времени наблюдения t.
Многие опыты показывают, что размер молекулы очень мал. Линейный размер молекулы или атома можно найти различными способами. Например, с помощью электронного микроскопа, получены фотографии некоторых крупных молекул, а с помощью ионного проектора (ионного микроскопа) можно не только изучить строение кристаллов, но определить расстояние между отдельными атомами в молекуле.
Моль вещества.
Относительная молекулярная масса (или относительная атомная масса) вещества Мr – это отношение массы молекулы (или атома) данного вещества к 1/12 массы атома углерода.
Мr = (m0): (m0C / 12)
где m0 – масса молекулы (или атома) данного вещества, m0C – масса атома углерода.Относительная молекулярная (или атомная) масса вещества показывает, во сколько раз масса молекулы вещества больше 1/12 массы изотопа углерода С12. Относительная молекулярная (атомная) масса выражается в атомных единицах массы.
Атомная единица массы – это 1/12 массы изотопа углерода С12. Точные измерения показали, что атомная единица массы составляет 1,660*10-27 кг, то есть
1 а.е.м. = 1,660 * 10-27 кг
В периодической системе Д.И. Менделеева для каждого элемента указана атомная масса, которая измеряется в атомных единицах массы (а.е.м.). Например, атомная масса магния равна 24,305 а.е.м., то есть магний в два раза тяжелее углерода, так как атомная масса углерода равна 12 а.е.м. (это следует из того, что 1 а.е.м. = 1/12 массы изотопа углерода, который составляет большую часть атома углерода).Массу молекулы можно вычислить путём сложения масс элементов, которые входят в состав молекулы. Например, масса молекулы воды (Н2О) будет равна:
m0Н2О = 2 * m0H + m0O = 2 * 1,00794 + 15,9994 = 18,0153 a.e.м. = 29,905 * 10-27 кг
Количество вещества принято считать пропорциональным числу частиц. Количество вещества – это физическая величина, характеризующая относительное число молекул и атомов в теле. Единица количества вещества называется молем (моль).
Моль равен количеству вещества системы, в которой содержится столько же молекул, сколько содержится атомов в 0,012 кг углерода С12. То есть, если у нас есть система с каким-либо веществом, и в этой системе столько же молекул этого вещества, сколько атомов в 0,012 кг углерода, то мы можем сказать, что в этой системе у нас 1 моль вещества.
Постоянная Авогадро
Количество вещества ν равно отношению числа молекул в данном теле к числу атомов в 0,012 кг углерода, то есть количеству молекул в 1 моле вещества.
ν = N / NA
где N – количество молекул в данном теле, NA – количество молекул в 1 моле вещества, из которого состоит тело.
NA – это постоянная Авогадро. Количество вещества измеряется в молях.
Постоянная Авогадро – это количество молекул или атомов в 1 моле вещества. Эта постоянная получила своё название в честь итальянского химика и физика Амедео Авогадро (1776 – 1856).
В 1 моле любого вещества содержится одинаковое количество частиц.
NA = 6,02 * 1023 моль-1
Молярная масса – это масса вещества, взятого в количестве одного моля:
μ = m0 * NA
где m0 – масса молекулы.
Молярная масса выражается в килограммах на моль (кг/моль = кг*моль-1).
Масса любого количества вещества m равна произведению массы одной молекулы m0 на количество молекул:
m = m0N = m0NAν = μν
Количество вещества равно отношению массы вещества к его молярной массе:
ν = m / μ
Массу одной молекулы вещества можно найти, если известны молярная масса и постоянная Авогадро:
m0 = m / N = m / νNA = μ / NA
7
Проще говоря, идеальный газ, это такой газ, что вся энергия, которая закачивается в него, идет только на увеличение скорости его молекул.
В реальном газе энергия идет еще и на вращение молекул, и на колебания атомов внутри молекул, и на разогрев стенок сосуда, в котором находится газ, и т. п.
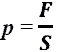 Давление - сила, приходящаяся на единицу площади. Давление - сила, приходящаяся на единицу площади. 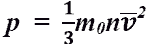 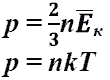 Давление газа - результат ударов его молекул о стенки сосуда. Давление газа - результат ударов его молекул о стенки сосуда. 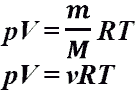 Давление газа. Уравнение Менделеева - Клайперона Давление газа. Уравнение Менделеева - Клайперона 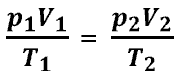 Давление газа. Уравнение Клайперона. Объединенный газовый закон (при m-const). Давление газа. Уравнение Клайперона. Объединенный газовый закон (при m-const).
| ||
Манометр — прибор, измеряющий давление жидкости или газа[1].
Принцип действия манометра основан на уравновешивании измеряемого давления силой упругой деформации трубчатой пружины или более чувствительной двухпластинчатой мембраны, один конец которой запаян в держатель, а другой через тягу связан с трибко-секторным механизмом, преобразующим линейное перемещение упругого чувствительного элемента в круговое движение показывающей стрелки.
1. Давление тем больше, чем больше количество ударов. Количество ударов определяется концентрацией молекул. Значит, давление зависит от концентрации.
2. Давление тем больше, чем больше энергия соударения, т.е. чем больше кинетическая энергия молекулы. Значит, давление зависит от массы молекул и квадрата скорости движения молекул.
3. Т.к. все молекулы движутся с различными скоростями, то некоторые молекулы не успеют долететь до стенки.
4. Т.к. молекулы движутся в различных направлениях, то необходимо учесть, что не все молекулы смогут принять участие в создании давления. Т.к. молекул много, то скорости молекул можно усреднить.
P=F/S
Величины, которые характеризуют физическое состояние тела называются термодинамическими параметрами состояния. Такими параметрами являются удельный объем, абсолютное давление, абсолютная температура, внутренняя энергия, энтальпия, энтропия, концентрация, теплоемкость.
Давление равно силе, действующей на единицу площади поверхности тела. Когда говорят о давлении газа или пара, то под давлением понимают суммарную силу ударов молекул этого газа или пара, направленную перпендикулярно к стенкам сосуда.
Объединенный газовый закон можно также записать в другой форме:

Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю (см. гл. 4), то соответствующая постоянная обозначается буквой R и называется молярная газовая постоянная, или просто газовая постоянная. Если давление выражено в атмосферах, постоянная R имеет значение
R = 8,314 Дж*К* моль-1
Объединенный газовый закон для одного моля газа приобретает вид

ообмен между телами отсутствует, тогда температуры одинаковы T2 = T1.
Температура - это мера нагретости тела (тепловое состояние тела). Если теплота переходит от одного тела к другому, это значит, что температура первого тела Т1 больше температуры второго тела Т2. Если же теплбъединяя законы Бойля - Мариотта и Гей-Люссака (уравнения 1 и 2), можно получить следующее уравнение:
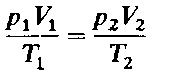 (3)
(3)
которое является математическим выражением объединенного газового закона, или закона состояния газов. Он позволяет вычислить, например, объем газа при определенных температуре и давлении, если известен его объем при других значениях температуры и давления.
Шкала температур Кельвина — это шкала, в которой начало отсчёта ведётся от абсолютного нуля.
Важное значение имеет разработка на основе термодинамической шкалы Кельвина Международных практических шкал, основанных на реперных точках — фазовых переходах чистых веществ, определенных методами первичной термометрии.
Абсолю́тный нуль температу́ры — минимальный предел температуры, которую может иметь физическое тело во Вселенной. по шкале Цельсия абсолютному нулю соответствует температура −273,15 °C
В технике, медицине, метеорологии и в быту в качестве единицы измерения температуры используется шкала Цельсия. В настоящее время в системе СИ термодинамическую шкалу Цельсия определяют через шкалу Кельвина: t(°С) = Т(К) — 273,15 (точно), т. е. цена одного деления в шкале Цельсия равна цене деления шкалы Кельвина. По шкале Цельсия температура тройной точки воды равна приблизительно 0,008 °C,[15] и, следовательно, точка замерзания воды при давлении в 1 атм очень близка к 0 °C. Точка кипения воды,, по определению равна 100 °C.
Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
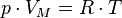 ,
,
где
· 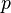 — давление,
— давление,
· 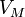 — молярный объём,
— молярный объём,
·  — универсальная газовая постоянная
— универсальная газовая постоянная
·  — абсолютная температура, К.
— абсолютная температура, К.
Так как  , где
, где  — количество вещества, а
— количество вещества, а 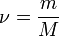 , где
, где  — масса,
— масса, 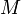 — молярная масса, уравнение состояния можно записать:
— молярная масса, уравнение состояния можно записать:

Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона
Универсальная газовая постоянная - одна из основных физических постоянных (R):
- входящая в уравнение состояния идеального газа; и
- численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К.
R = 8.31441 +/- 0.00026 Дж/(моль*К). pV0 = MRT/m, где V0 - объем одного моля газа; m - молярная масса газа; R - универсальная газовая постоянная. R = 8,31 Па*м3/К*моль, К - температура в градусах Кельвина.
| 1. Закон Авогадро. В равных объемах различных газов при одинаковых внешних условиях находится одинаковое число молекул (атомов). Условие: V1=V2=…=Vn; p1=p2=…=pn; T1=T2=…=Tn | |
Доказательство: 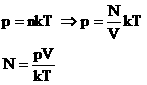 Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково.
Следовательно, при одинаковых условиях (давление, объем, температура) число молекул не зависит от природы газа и одинаково.
| |
2. Закон Дальтона.
Давление смеси газов равно сумме парциальных (частных) давлений каждого газа.
Доказать: p=p1+p2+…+pn
Доказательство: 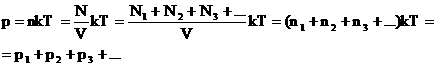
| |
| 3. Закон Паскаля. Давление, производимое на жидкость или газ, передается во все стороны без изменения. |
Изобарный процесс — процесс изменения состояния термодинамической системы при постоянном давлении (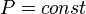 )
)
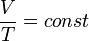
Зависимость объёма газа от температуры при неизменном давлении была экспериментально исследована в 1802 году Жозефом Луи Гей-Люссаком. Закон Гей-Люссака: При постоянном давлении и неизменных значениях массы газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
Изохорный процесс
Изохорный процесс — процесс изменения состояния термодинамической системы при постоянном объёме ( ). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:
). Для идеальных газов изохорический процесс описывается законом Шарля: для данной массы газа при постоянном объёме, давление прямо пропорционально температуре:
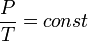
Линия, изображающая изохорный процесс на диаграмме, называется изохорой.
Изотермический процесс
Изотермический процесс — процесс изменения состояния термодинамической системы при постоянной температуре (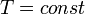 )(
)(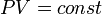 ). Изотермический процесс описывается законом Бойля — Мариотта: При постоянных температуре и массе газа произведение давления газа на его объём постоянно
). Изотермический процесс описывается законом Бойля — Мариотта: При постоянных температуре и массе газа произведение давления газа на его объём постоянно
Изотермический процесс — процесс изменения состояния термодинамической системы при постоянной температуре (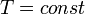 )(
)(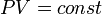 ). Изотермический процесс описывается законом Бойля — Мариотта: При постоянных температуре и массе газа произведение давления газа на его объём постоянно
). Изотермический процесс описывается законом Бойля — Мариотта: При постоянных температуре и массе газа произведение давления газа на его объём постоянно
Утверждение закона Бойля — Мариотта состоит в следующем[2][3][4]:
При постоянных температуре и массе газа произведение давления газа на его объём постоянно.
В математической форме это утверждение записывается в виде формулы
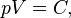
где 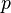 — давление газа;
— давление газа; 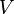 — объём газа, а
— объём газа, а  — постоянная в оговоренных условиях величина. В общем случае значение
— постоянная в оговоренных условиях величина. В общем случае значение  определяется химической природой, массой и температурой газа.
определяется химической природой, массой и температурой газа.
Очевидно, что если индексом 1 обозначить величины, относящиеся к начальному состоянию газа, а индексом 2 — к конечному, то приведённую формулу можно записать в виде
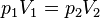 .
.
Из сказанного и приведённых формул следует вид зависимости давления газа от его объёма в изотермическом процессе:

Эта зависимость представляет собой другое, эквивалентное первому, выражение содержания закона Бойля — Мариотта[3][4]. Она означает, что
Давление некоторой массы газа, находящегося при постоянной температуре, обратно пропорционально его объёму.
Тогда связь начального и конечного состояний газа, участвовавшего в изотермическом процессе, можно выразить в виде:
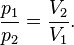
Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малогоколичества теплоты δ Q, полученного телом, к соответствующему приращению его температуры δ T [1]:
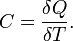
Единица измерения теплоёмкости в Международной системе единиц (СИ) — Дж/К.
Внутренняя энергия тела зависит от средней кинетической энергии его молекул, а эта энергия, в свою очередь, зависит от температуры. Поэтому, изменяя температуру тела, мы изменяем и его внутреннюю энергию. При нагревании тела его внутренняя энергия увеличивается, при охлаждении уменьшается.
Проделаем опыт. Укрепим на подставке тонкостенную латунную трубку. Нальем в нее немного эфира и плотно закроем пробкой. Теперь обовьем трубку веревкой и начнем натирать ею трубку, быстро вытягивая в веревку то в одну, то в другую сторону. Через В некоторое время внутренняя энергия трубки с эфиром возрастет настолько, что эфир закипит и образовавшийся пар вытолкнет пробку (рис. 60).
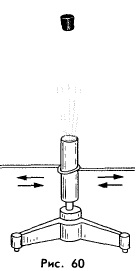
Этот опыт показывает, что внутреннюю энергию тела можно изменить путем совершения над телом работы, в частности трением.
Электрическое поле — особая форма материи, существующая вокруг тел или частиц, обладающих электрическим зарядом, а также в свободном виде в электромагнитных волнах. Электрическое поле непосредственно невидимо, но может наблюдаться по его действию и с помощью приборов. Основным действием электрического поля является ускорение тел или частиц, обладающих электрическим зарядом.
В пространстве вокруг электрического заряда существует электрическое поле.
Электрическое поле можно изобразить графически с помощью силовых линий электрического поля, которые имеютнаправление.
| Электрическое поле положительного заряда. | Электрическое поле отрицательного заряда |

| 
|
Электрическое поле заряда действует с некоторой силой F эл на всякий другой заряд, помещенный
в поле данного заряда.
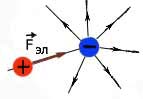
Сила с которой электрическое поле действует на внесенный в него заряд, называется электрической силой. Она направлена всегда вдоль силовых линий электрического поля. Действие электрического поля зависит от растояния, чем меньше растояние до заряда, образующего поле, тем сильней дейсвие поля (тем больше электрическая сила).
Электростатический потенциал — специальный термин для возможной замены общего термина электродинамики скалярный потенциал в частном случае электростатики (исторически электростатический потенциал появился первым, а скалярный потенциал электродинамики — его обобщение). Употребление термина электростатический потенциал определяет собой наличие именно электростатического контекста. Если такой контекст уже очевиден, часто говорят просто о потенциале без уточняющих прилагательных.
Электростатический потенциал равен отношению потенциальной энергии взаимодействия заряда с полем к величине этого заряда:
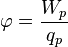
Сила взаимодействия заряженых неподвижных тел(или взаемодействие точечных електр. зарядов), размерами которых можно пренебречь по сраснению с расстоянием между ними, прямо пропорциальна значениям их зарядов и обратно пропорциональна квадрату расстояния между ними.
F = k (q1 * q2) / r2
В векторном виде в формулировке Ш. Кулона закон записывается следующим образом:
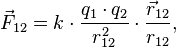
где 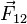 — сила, с которой заряд 1 действует на заряд 2;
— сила, с которой заряд 1 действует на заряд 2; 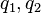 — величина зарядов;
— величина зарядов; 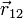 — радиус-вектор (вектор, направленный от заряда 1 к заряду 2, и равный, по модулю, расстоянию между зарядами —
— радиус-вектор (вектор, направленный от заряда 1 к заряду 2, и равный, по модулю, расстоянию между зарядами — 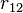 );
); 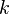 — коэффициент пропорциональности.
— коэффициент пропорциональности.
илы электростатического взаимодействия зависят от формы и размеров наэлектризованных тел, а также от характера распределения заряда на этих телах. В некоторых случаях можно пренебречь формой и размерами заряженных тел и считать, что каждый заряд сосредоточен в одной точке. Точечный заряд – это электрический заряд, когда размер тела, на котором этот заряд сосредоточен, намного меньше расстояния между заряженными телами. Приближённо точечные заряды можно получить на опыте, заряжая, например, достаточно маленькие шарики.
Взаимодействие двух покоящихся точечных зарядов определяет основной закон электростатики – закон Кулона. Этот закон экспериментально установил в 1785 году французский физик Шарль Огюстен Кулон (1736 – 1806). Формулировка закона Кулона следующая:
| Сила взаимодействия двух точечных неподвижных заряженных тел в вакууме прямо пропорциональная произведению модулей зарядов и обратно пропорциональна квадрату расстояния между ними. |
Эта сила взаимодействия называется кулоновская сила, и формула закона Кулона будет следующая:
F = k · (|q1| · |q2|) / r2
где |q1|, |q2| – модули зарядов, r – расстояния между зарядами, k – коэффициент пропорциональности.
Коэффициент k в СИ принято записывать в форме:
k = 1 / (4πε0ε)
где ε0 = 8,85 * 10-12 Кл/Н*м2 – электрическая постоянная, ε – диэлектрическая проницаемость среды.
Для вакуума ε = 1, k = 9 * 109 Н*м/Кл2.
Сила взаимодействия неподвижных точечных зарядов в вакууме:
F = [1 /(4πε0)] · [(|q1| · |q2|) / r2]
Если два точечных заряда помещены в диэлектрик и расстояние от этих зарядов до границ диэлектрика значительно больше расстояния между зарядами, то сила взаимодействия между ними равна:
F = [1 /(4πε0)] · [(|q1| · |q2|) / r2] = k · (1 /π) · [(|q1| · |q2|) / r2]
Дата публикования: 2015-11-01; Прочитано: 666 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
