 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лимитирующая стадия гетерогенного процесса и способы её определения
|
|
Лимитирующая стадия - это та стадия процесса, которая идет дольше других. Именно она определяет скорость протекания процесса.
Если реакция осуществляется путем последовательно протекающих стадий (не обязательно все из них являются химическими) и одна из этих стадий требует значительно большего времени, чем остальные, то есть идет намного медленнее, то такая стадия называется лимитирующей. Именно эта самая медленная стадия определяет скорость всего процесса. Рассмотрим в качестве примера каталитическую реакцию окисления аммиака. Здесь возможны два предельных случая.
1. Поступление молекул реагентов – аммиака и кислорода к поверхности катализатора (физический процесс) происходит значительно медленнее, чем сама каталитическая реакция на поверхности. Тогда для повышения скорости образования целевого продукта – оксида азота совершенно бесполезно повышать эффективность катализатора, а надо позаботиться об ускорении доступа реагентов к поверхности.
2. Подача реагентов к поверхности происходит значительно быстрее самой химической реакции. Вот здесь имеет смысл совершенствовать катализатор, подбирать оптимальные условия для каталитической реакции, так как лимитирующей стадией в данном случае является каталитическая реакция на поверхности.
Многие процессы химической технологии многостадийны, т.е. распадаются на ряд стадий (этапов, путей). Как правило, одна из стадий лимитирует процесс. Если мы хотим оказать воздействие на такой процесс, то воздействие должно оказываться именно на лимитирующую стадию. То, какая именно стадия лимитирует процесс, определяется, с одной стороны, соотношением скоростей разных стадий, а с другой – их взаимным расположением. Если какой-либо процесс может параллельно осуществляться двумя или более различными способами, то, как правило, лимитирует процесс тот способ, который обеспечивает наибольшую скорость (интенсивность). И наоборот, если процесс распадается на последовательные стадии, которые он должен пройти, то лимитировать процесс будет самая медленная, длительная стадия. Таким образом, лимитирующая стадия – стадия, которая определяет общую скорость многостадийного процесса; определяется взаимным расположением стадий и соотношением их скоростей. Встречаются процессы, когда ни медленная, ни быстрая стадия не могут лимитировать процесс. Это бывает тогда, когда, казалось бы, нелимитирующая стадия влияет на протекание той стадии, которая должна была бы лимитировать.
^ Интенсификация процессов – это увеличение скорости переноса субстанции. Как известно, скорость переноса пропорциональна движущей силе процесса и обратно пропорциональна сопротивлению (единый кинетический закон):  .
.
Движущая сила определяется степенью отклонения реального состояния от равновесного и гидродинамическими условиями протекания процесса. Сопротивление в значительной степени определяется механизмом переноса.
Скорость многостадийного процесса определяется лимитирующей стадией. Выше были описаны два механизма переноса: продольный и поперечный. Причем необходимо знать, что сопротивление
при переносе субстанции в потоке в поперечном направлении, в основном, определяется явлениями, протекающими в пограничном слое.
В большинстве случаев перенос субстанций через пограничный слой осуществляется самым медленным механизмом – молекулярным,
и поэтому эта стадия является лимитирующей. То есть те технологические и конструктивные методы, применение которых приводит
к уменьшению толщины пограничного слоя, увеличивают и скорость этой стадии, а следовательно, и всего процесса переноса субстанции
в целом.
Когда сопротивление одной из стадий существенно превышает сопротивление других стадий. Такая стадия называется лимитирующей.
Особенности лимитирующей стадии.
1) обладает максимальным сопротивлением и минимальным коэффициентом интенсивности;
2) скорость всего процесса равна скорости лимитирующей стадии;
3) лимитирующая стадия имеет максимальное изменение концентрации реагента.

Профиль изменения концентрации газообразного реагента при лимитировании гетерогенного процесса внешней (а), внутренней (б), диффузиями и химической реакцией (в).
Способы определения лимитирующей стадии.
1) На внешнюю диффузию максимальное влияние оказывает скорость газового потока.
Повысить скорость внешней диффузии можно, увеличивая движущую силу, которая равна разности концентраций CAg и CAs, либо коэффициент массоотдачи.
Для увеличения β=D/ δ нужно: если это возможно, повысить коэффициент молекулярной диффузии D; уменьшить толщину газовой пленки δ.
Чем больше скорость газового потока, тем меньше пленка вокруг частицы.

I – внешняя диффузия
II – переходная область
III – кинетическая область
На внутреннюю диффузию влияет степень измельчения частиц.
Повысить скорость внутреннедиффузионной стадии возможно в основном увеличением коэффициента массоотдачи β’=D/∆r, r – радиус ядра частицы. Уменьшение размеров твердой частицы (измельчение) автоматически приводит и к уменьшению толщины слоя твердых продуктов, т.е. к увеличению коэффициента массоотдачи β’. Т.о. измельчение твердых частиц – основной путь интенсификации внутренней диффузии.

II – внутренняя диффузия
1/R – степень измельчения.
Температура влияет на химическую реакцию.
Скорость химической реакции может быть увеличена вследствие возрастания концентрации газообразного реагента САс, либо же главным образом вследствие роста константы скорости химической реакции kS. Т.к. в соответствие с уравнением Аррениуса константа скорости химической реакции с ростом температуры увеличивается по экспоненциальной зависимости, то основной путь интенсификации гетерогенного процесса, протекающего в кинетической области, - повышение температуры.

2) сравнение теоретических и экспериментальных данных
- сравнение эспериментально полученной кинетической зависимости степени превращения твердого реагента от времени пребывания в реакторе хВ(τ) и теоретических зависимостей хВ(τ) для разных областей протекания гетерогенного процесса.

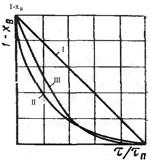
I – внешняя диффузия
II – внутренняя диффузия
III – химическая реакция
- на основе опытных данных о величинах хВ в разные моменты времени τ рассчитывают время полного превращения твердой частицы по уравнениям:
лимитируется внешняя диффузия: τI полн=τ/ xB
внутренняя диффузия: τпII = τ/[1-3(1-хВ)2/3+2(1-хВ)]
химическая реакция: τпIII = τ/[1-(1-хВ)1/3]
По своему физическому смыслу для данных условий τп – константа, не зависящая от действительного времени пребывания частиц в реакторе τ. Поэтому, если лимитирующая стадия существует, то обработка экспериментальных данных по одному из приведенных уравнений должна показать, что τп остается постоянным при любых τ.

Дата публикования: 2015-10-09; Прочитано: 16192 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
