 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Урок 6. Параметрические электролитические преобразователи сопротивления
|
|
Электролитические преобразователи относятся к типу электрохимических преобразователей. В общем случае электрохимический преобразователь представляет собой электролитическую ячейку, заполненную раствором с помещенными в нее электродами, служащими для включения преобразователя в измерительную цепь. Как элемент электрической цепи электролитическая ячейка может характеризоваться развиваемой ею э.д.с., падением напряжения от проходящего тока, сопротивлением, емкостью и индуктивностью. Выделяя зависимость между этими электрическими параметрами и измеряемой неэлектрической величиной и подавляя действие других факторов, можно создать преобразователи для измерения состава и концентрации жидких и газообразных сред, давлений, перемещений, скорости, ускорения и др. величин. Электрические параметры ячейки зависят от природы и состава раствора и электродов, химических превращений в ячейке, температуры, скорости перемещения раствора и др. Связи между электрическими параметрами электрохимических преобразователей и неэлектрическими величинами определяются законами электрохимии.
Растворы солей, кислот и оснований в воде и в ряде других растворителей обладают электропроводностью и называются: проводниками второго рода. При растворении происходит диссоциация - расщепление молекул на положительные и отрицательные ионы. Вещества, расщепляющиеся при растворении на ионы и образующие электропроводящие растворы, называются электролитами. Под воздействием электрического поля. положительные ионы движутся к отрицательному электроду, а отрицательные ионы к положительному электроду и переносят электрические заряды.
Электропроводность чистой дистиллированной воды близка к нулю и возрастает по мере повышения концентрации растворенных веществ. Растворы характеризуются весовой концентрацией Р, измеряемой в граммах на литр, миллиграммах на литр или в миллиграммах на миллилитр, эквивалентной или молярной концентрацией С, измеряемой в грамм-эквивалентах ( Г- экв) или грамм-молекулах (Г-моль) на литр и химической активностью а.
Активность а равна произведению эквивалентной концентрации С на коэффициент активности f, равный единице для растворов с небольшой концентрацией и уменьшающийся по мере повышения концентрации (из-за уменьшения степени диссоциации и подвижности ионов).
Удельная электропроводность раствора пропорциональна его эквивалентной химической активности
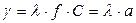 (4.22)
(4.22)
Коэффициент l называется эквивалентной электропроводностью. Удельная электропроводность зависит нелинейно от весовой концентрации Р или эквивалентной концентрации С. Зависимость проводимости электролитов от их концентрации дает возможность использовать электролитическую ячейку в качестве измерительного преобразователя, естественной входной является значение химической активности а раствора. Выходной величиной преобразователя является электрическая проводимость между электродами.
Принцип действия электролитических преобразователей основан на зависимости сопротивления электролитической ячейки от состава и концентрации электролита, а также от геометрических размеров ячейки. Сопротивление столба жидкости электролитического преобразователя равно
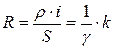 (4.23)
(4.23)
где g = 1/r - удельная проводимость электролита; k - постоянная преобразователя, зависящая от соотношения его геометрических размеров, определяемая обычно экспериментально.
Дата публикования: 2015-10-09; Прочитано: 365 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
