 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Атомные и ионные радиусы
|
|
Атомы и ионы не имеют строго определенных границ вследствие волновой природы электронов. Поэтому определяют условные радиусы атомов и ионов, связанных друг с другом химической связью в кристаллах.
Радиусы атомов металлов в периодах с ростом порядкового номера элементов уменьшаются, т.к. при одинаковом числе электронных слоев возрастает заряд ядра, а, следовательно, и притяжение им электронов.
В пределах каждой группы элементов, как правило, радиусы атомов увеличиваются сверху вниз, т.к. возрастает число энергетических уровней. Радиусы ионов также находятся в периодической зависимости от порядкового номера элемента.
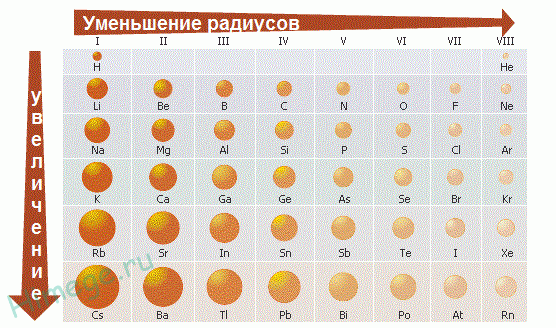
Пример. Как изменяются размеры атомов внутри периода, при переходе от одного периода к другому и в пределах одной группы? Какие элементы имеют минимальное и максимальное значения размера атома?
Решение.
Внутри периода (слева направо) размеры атомов уменьшаются, т.к. увеличивается заряд ядра и электроны сильнее притягиваются к ядру. В главных подгруппах размеры атомов увеличиваются, т.к. увеличивается число электронных слоев. В побочных подгруппах такие изменения меньше заметны, за счет d -сжатия, а при переходе из V в VI период происходит даже уменьшение уменьшение размеров атомов за счет f -сжатия.
Согласно этим правилам минимальное значение размера атома имеет гелий, а максимальное – цезий. Франций не имеет долгоживущих изотопов (природный изотоп радиоактивен, период полураспада 21 минута).
Металлы и неметаллы. Деление элементов и простых веществ на металлы и неметаллы в известной степени условно.
По физическим свойствам металлы характеризуются высокой теплопроводностью и электрической проводимостью, отрицательным температурным коэффициентом проводимости, специфическим металлическим блеском, ковкостью, пластичностью и т.п.
По химическим свойствам металлы характеризуются основными свойствами оксидов и гидроксидов и восстановительными свойствами.
Подобные различия в свойствах простых веществ связаны с характером химической связи при их образовании. Металлическая связь в металлах образуется при дефиците валентных электронов, а ковалентная в неметаллах при их достаточном количестве. Исходя из этого, можно провести вертикальную границу между элементами IIIA и IV групп. Слева – элементы с дефицитом валентных электронов, справа – с избытком. Это граница Цинтля.
Пример. Чем отличаются типичные металлы от неметаллов? Почему и как изменяются металлические свойства с увеличением порядкового номера элементов?
Решение.
В периодической системе элементов в основном находятся металлы, неметаллов немного (всего 22). К металлам относятся все s -элементы. Это связано с наличием у них малого числа валентных электронов (1 или 2), в результате этого дефицита электронов образуется металлическая связь.
Все d - и f -элементы тоже являются металлами. При образовании химических связей в качестве валентных электронов у атомов d -элементов выступают s -электроны внешнего энергетического уровня и часть или все d -электроны предпоследнего уровня, причем d -электроны участвуют в образовании химических связей лишь после того, как будут связаны все внешние s -электроны. Кроме того, легкости удаления s -электронов способствует эффект экранирования заряда ядра. Он состоит в уменьшении воздействия на электрон положительного заряда ядра из-за наличия между рассматриваемым электроном и ядром других электронов (это d - или f -электроны).
У р-элементов происходит конкуренция между увеличением числа валентных электронов (неметаллические свойства) и экранированием заряда ядра (усиливаются металлические свойства). В связи с этим у р-элементов по подгруппе сверху вниз увеличивается устойчивость низших степеней окисления.
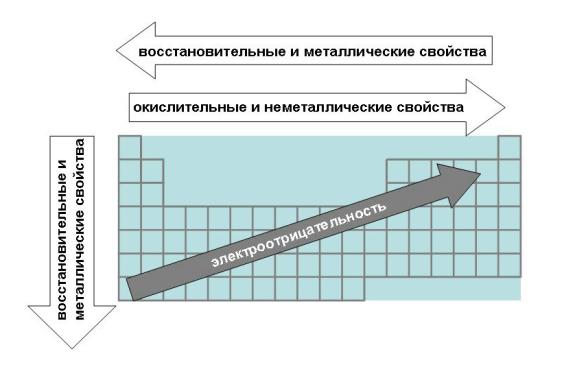
По периоду справа налево увеличиваются неметаллические свойства атомов, за счет увеличения заряда ядра атома и трудности отдачи электронов. По подгруппе сверху вниз увеличиваются металлические свойства, т. к. ослабевает связь внешних электронов с ядром.
Свойства соединений подразделяются на кислотно-основные и окислительно-восстановительные. Периодическая система элементов хорошо объясняет эти закономерности. Рассмотрим это на примере гидроксидов.
Если элемент имеет степень окисления маленькую (+1 или +2), например, Na—O—H, то связь Na—O менее прочная, чем O—H и разрыв связи происходит по менее прочной связи.
Na—O—H D Na+ + OH-. Соединение обладает основными свойствами.
Если степень окисления элемента большая (от +5 до +7), то связь элемент – кислород прочнее, чем связь О—Н и соединение обладает кислотными свойствами. В азотной кислоте степень окисления азота большая (+5).
| Н |
| О |
| О |
| О |
| N |
D H+ + NO3-
| Степень окисления элемента | +1 и +2 | +3 и +4 | +5, +6, +7 |
| Кислотно- основные свойства | Основания | Амфотерные соединения | Кислоты |
| Исключения | La3+, Bi3+, Tl3+ | Zn+2, Be+2, Sn+2, Pb+2, Ge+2 | Гидроксиды неметаллов в любой степени окисления образуют только кислоты |
Соединения в степени окисления +3 и +4 проявляют амфотерные свойства, т.е. в зависимости от партнера по реакции могут проявлять как кислотные, так и основные свойства. Но есть исключения Zn+2, Be+2, Sn+2, Pb+2, Ge+2 имеют степень окисления +2, но являются амфотерными соединениями.
По периоду справа налево увеличивается высшая степень окисления, равная номеру группы, поэтому увеличиваются неметаллические и кислотные свойства.
По подгруппе сверху вниз увеличиваются металлические и основные свойства, т.к. увеличивается размер атома и связь с соседним атомом ослабляется.
Таким образом, периодическая система позволяет проанализировать положение простых веществ в связи с особенностями их свойств (металлы, неметаллы).
Периодический закон Менделеева дает возможность определять и свойства простых веществ в химических соединениях. Впервые предсказание свойств было осуществлено самим Менделеевым. Он рассчитал свойства и тех элементов, которые еще не были открыты.
1.2.2. Общая характеристика металлов IА – IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Отличительной особенностью металлов, находящихся в I-III группах главных подгруппах является дефицит валентных электронов.
В IА группе находятся щелочные металлы, они имеют один s -электрон на внешнем электронном слое, который при химических реакциях легко теряют, проявляя степень окисления +1. Поэтому щелочные металлы являются сильными восстановителями.

Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать » означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Согласно положению этих элементов в Периодической системе изменение их свойств представлено на рисунке.

По группе сверху вниз увеличиваются радиусы атомов за счет увеличения число электронных слоев. Уменьшается энергия ионизации (легкость отрыва электрона от атома), что соответствует увеличению восстановительных, а значит и металлических свойств.
Химические свойства щелочных металлов кратко можно представить в таблице.

Щелочные металлы активно реагируют с кислородом с образованием оксидов, пероксидов и надпероксидов. С серой при нагревании образуют сульфиды, с водородом – гидриды, с галогенами – галогениды.
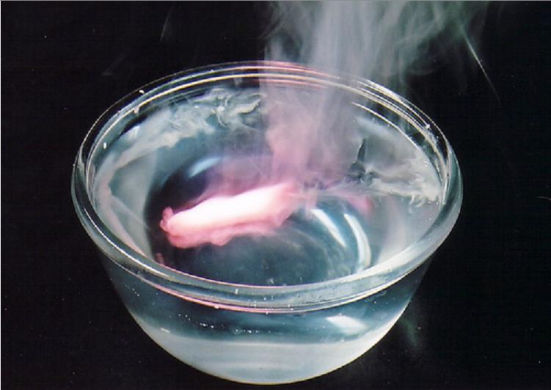
Очень активно взаимодействуют с водой, часто с воспламенением выделяющегося водорода.
Атомы элементов IIА группе имеют на внешнем электронном уровне два s‑электрона: ns2.
В реакциях атомы элементов подгруппы легко отдают оба электрона внешнего энергетического уровня и образуют соединения, в которых степень окисления элемента равна +2.

Металлы этой подгруппы менее активны, чем металлы IА группы. Бериллий является амфотерным металлом, магний образует основание – слабый электролит, а кальций, стронций и барий образуют щелочи.
Это активные металлы являются сильными восстановителями. Из металлов этой подгруппы несколько менее активен бериллий, что обусловлено образованием на поверхности этого металла защитной оксидной пленки.
Амфотерность бериллия проявляется в том, что он взаимодействует с водными растворами щелочей с образованием комплексной соли и выделением водорода:
Be + 2NaOH + 2H2O = Na2[Be(OH)4] + H2#.
Остальные металлы II группы со щелочами не реагируют.
В IIIА группе находятся бор (В), алюминий (Al), галлий (Ga), индий (In), таллий (Tl).
В этой подгруппе особенной ярко проявляется изменение кислотно-основных свойств по подгруппе сверху вниз от кислотных до основных. Если соединения бора обладают кислотными свойствами, алюминий, галлий и индий – амфотерными, то соединения таллия – основными.
На внешнем энергетическом уровне алюминия имеются свободные р‑орбитали, что позволяет ему переходить в возбужденное состояние. В возбужденном состоянии атом алюминия образует три ковалентные связи или полностью отдает три валентных электрона, проявляя степень окисления +3.

Общим для элементов этих групп является то, что они характеризуются небольшим (1-3) числом электронов на внешнем уровне их атомов и легкостью потери электронов, что отражает низкие значения электроотрицательности.
Алюминий, галлий, бериллий проявляют уже амфотерные (то есть металлические и неметаллические – металлоидные) свойства.
Дата публикования: 2015-10-09; Прочитано: 7120 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
