 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
KAl(SO4)2•12H2O
|
|
калий-алюминий сульфат
Свойства:
Алюмокалиевые квасцы – прозрачное кристаллическое вещество, хорошо растворимое в горячей воде и плохо в холодной. На вкус сладковатые квасцы, немного вяжущие рот, практически не выветриваемы на открытом воздухе. Разогрев квасцов алюмокалиевых, до температуры 120 °С, приводит к превращению из кристаллического состояния в состояние порошковое, плохо растворимое в любой воде. Из водных растворов выделяется в виде кристаллогидрата KAl(SO4)2•12H2O — бесцветных кристаллов кубической сингонии, пространственная группа P a3, параметры ячейки a = 1,2158 нм, температура плавления 92°С (в собственной кристаллизационной воде).
Получение:
1. Совместная кристаллизация сульфатов калия и алюминия:
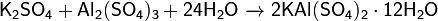
2. Обжиг минерала алунита K2SO4•Al2(SO4)3•Al(OH)3 с последующим выщелачиванием и перекристаллизацией.
Идентификация:
1 Реакции обнаружения иона калия.
а) Окрашивание бесцветного пламени горелки в фиолетовый цвет или при рассматривании через синее стекло – пурпурно-красный.
б) Осаждение ионов калия винной кислотой.
При взаимодействии солей калия с раствором кислоты винной образуется белый кристаллический осадок (к раствору предварительно прибавляют растворы натрия карбоната и натрия сульфида – не должны выпадать осадки:

в) с раствором натрия кобальти нитрита в присутствии кислоты уксусной разведенной образуется желтый или желто-оранжевый осадок:
К+ + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2 Na+
2. Реакции обнаружения сульфат ионов.
а) сульфат-ионы с раствором бария хлорида в присутствии кислоты хлористоводородной разведенной образуют белый осадок:
SO42- + BaCl2 → BaSO4↓ + 2Cl-
3. Реакции обнаружения ионов алюминия:
При взаимодействии солей алюминия с раствором натрия гидроксида образуется гелеобразный белый осадок, растворяющийся в избытке реактива. Белый гелеобразный осадок вновь выпадает при прибавлении к образующемуся раствору аммония хлорида Р:
Al3 + 3OH- → Al(OH)3↓
Al(OH)3 + 3NaOH → Na3[Al(OH)6]
Na3[Al(OH)6] → NaAlO2 + 2 H2O + 2NaOH
NaAlO2 + H2O +NH4Cl → Al(OH)3↓ + NH3 + NaCl
4. Разлагается при сильном нагревании:
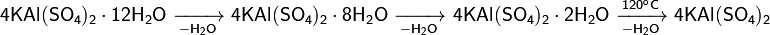
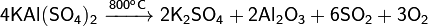
5. Кристаллогидрат при нагревании плавится в кристаллизационной воде, а затем дегидратируется в несколько стадий с образованием конечного продукта — безводного, или «жжёного», сульфата алюминия-калия:
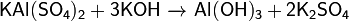
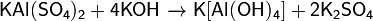

6. Реагирует с щелочами с различным результатами, в зависимости от концентрации и температуры:
Испытания на чистоту:
Чистоту определяют по отсутствию хлоридов, тяжёлых металлов, аммиака, в соответствии с требованиями ГФУ:
Хлориды определяют по реакции с раствором аргентум нитрата в присутствии кислоты нитратной разведенной:
Cl- + AgNO3 → AgCl↓ + NO3-
Опалесценция испытуемого раствора не должна превышать опалесценцию эталона.
Определение примеси тяжелых металлов проводят по методам А, В, С, D, E, F взаимодействием с тиоацетамидным реактивом по определенной методике в зависимости от того, какую природу имеет исследуемое вещество:
CH3C(S)NH2 + H2O → CH3COO- +NH4+ + H2S↑
H2S + Pb2+ → PbS↓ + 2H+
Коричневое окрашивание исследуемого раствора не должен быть интенсивнее эталона. В сравнении с холостым раствором эталона должен иметь светло-коричневое окрашивание.
Испытания на соли аммония:
Метод А. Реактивом для определения этой примеси служит реактив Несслера (щелочной раствор тетрайодомеркурата калия Р.):
Через 5 мин желтое окрашивание испытуемого раствора по интенсивности не должно превышать окрашивание эталона.
Количественное определение.
1) Гравиметрия, после осаждения 8-оксихинолином – выделившийся хинолят алюминия взвешивают и умножают на 0,1110, что соответствует содержанию оксида алюминия во взятой навеске.

3 + Al3+ → + 3H+
Применение: как вяжущее, антисептическое, кровоостанавливающее средство.
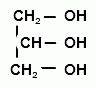 Глицерин (Glycerolum)
Глицерин (Glycerolum)
(1,2,3-триоксипропан, пропантриол-1,2,3)
Свойства: сиропообразная, маслянистая на ощупь, бесцветная или почти бесцветная, прозрачная жидкость. Очень гигроскопична. Смешивается с водой и спиртом, мало растворим в ацетоне, практически не растворим в эфире, жирных и эфирных маслах.
Т. пл. 17,9°С, Т. кип. 290°С (со слабым разложением).
Получение. Омыление жиров (сложных эфиров глицерина и высших алифатических кислот):
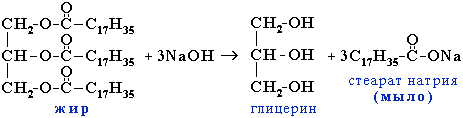
Идентификация:
1. Физико-химические методы: ИК- спектроскопия, определяют показатель преломления (1,4710-1.4744).
2. Реакция окисления кислотой серной и калия дихроматом; на границе раздела двух жидкостей образуется голубое кольцо.
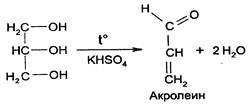 3. Образование акролеина. В присутствии калия гидросульфата происходит дегидратация глицерина и образуется непредельный альдегид – акролеин - неприятного специфического и раздражающего запаха (обнаруживают по появлению черного пятна на бумаге, пропитанной щелочным раствором калия тетрайодомеркурата):
3. Образование акролеина. В присутствии калия гидросульфата происходит дегидратация глицерина и образуется непредельный альдегид – акролеин - неприятного специфического и раздражающего запаха (обнаруживают по появлению черного пятна на бумаге, пропитанной щелочным раствором калия тетрайодомеркурата):
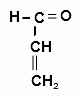
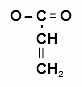
+ K2HgI4 + 3 KOH → Hg↓ + 4 KI + + 2 H2O
4. Глицерин как многоатомный спирт проявляет более сильные кислотные свойства и взаимодействует с меди гидроксидом, образуя комплекс синего цвета:
CuSO4 + 2 NaOH → Cu(OH)2↓ + Na2 SO4 - голубой
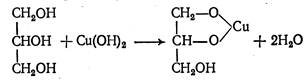
Испытания на чистоту: в субстанции проводят определение прозрачности, цветности, реакции среды, альдегидов, сахаров, хлоридов и др.
Количественное определение:
1. Алкалиметрия после окисления субстанции перйодатом натрия (заместительное титрование с контрольным опытом), индикатор – фенолфталеин; s=1 (ГФУ):
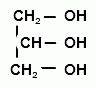
+ 2 NaIO4 → 2HCOH + HCOOH +2 NaIO3
HCOOH + NaOH → HCOONa +H2O
2. Алкалиметрия после ацетилирования субстанции (обратное титрование).
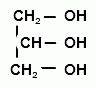
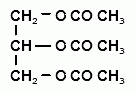
+ 3 (CH3CO)2O → + 3 CH3COOH
Избыток уксусного ангидрида гидролизуют, образовавшуюся кислоту уксусную нейтрализуют раствором натрия гидроксида по фенолфталеину:
CH3COOH + NaOH → CH3COONa + H2O
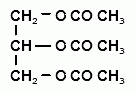 Определяют полученный эстер избытком титрованного раствора натрия гидроксида (s=1/3):
Определяют полученный эстер избытком титрованного раствора натрия гидроксида (s=1/3):
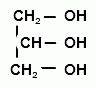
+ 3 NaOH → + 3 CH3COONa
Остаток натрия гидроксида оттитровывают кислотой хлористоводородной:
NaOH + HCl → NaCl + H2O
Применение: основа для растворов, как неводный растворитель. Безводный глицерин может вызывать ожоги.
Спирт этиловый 96%
(Etanolum 96% per centum)
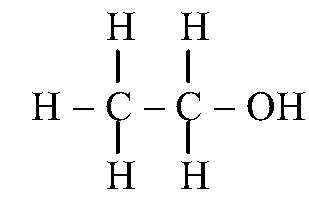
Свойства: бесцветная, прозрачная, летучая, легковоспламеняющаяся жидкость, давление насыщенного пара, кПа: lg p = 7.81158-1918.508/(252.125+t) при температуре от −31 до 78°С; теплота сгорания — 1408 кДж/моль; теплота образования -239,4 кДж/моль. Кипит при температуре около 78ºС. Горит голубым бездымным пламенем. Смешивается с водой и метилен хлоридом.
 Получение. Спиртовое брожение крахмалсодержащего сырья:
Получение. Спиртовое брожение крахмалсодержащего сырья:
 2 (C6H10O5)n + n H2O n C12H22O11 2n C6H12O6 →
2 (C6H10O5)n + n H2O n C12H22O11 2n C6H12O6 →
4n C2H5OH + 4n CO2↑
В процессе получения образуется ряд побочных продуктов: ПВК, ацетальдегид, глицерин, сивушные масла (высшие спирты). Для очистки от примесей этанол подвергают перегонке.
Идентификация.
1. Физико–химические методы: определяют относительную плотность этанола, ИК-спектроскопия (ГФУ).
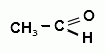 2. Окисление раствором калия перманганата в присутствии кислоты серной розведенной. Образующийся бензальдегид идентифицируют по реакции с на трия нитропруссидом и пиперазина гидратом. На бумаге, пропитанной названными реактивами, появляется интенсивное голубое окрашивание (ГФУ):
2. Окисление раствором калия перманганата в присутствии кислоты серной розведенной. Образующийся бензальдегид идентифицируют по реакции с на трия нитропруссидом и пиперазина гидратом. На бумаге, пропитанной названными реактивами, появляется интенсивное голубое окрашивание (ГФУ):
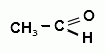 С2H5OH ↑
С2H5OH ↑
 Na2[Fe(CN)5NO] + Na2[Fe(CN)5CH2COH]
Na2[Fe(CN)5NO] + Na2[Fe(CN)5CH2COH]
3. Йодоформная проба (ГФУ):
C2H5OH + 4I2 + 6 NaOH → CHI3↓ + 5 NaI + HCOONa + 5 H2O
Образуется желтый осадок йодоформа с характерным запахом.
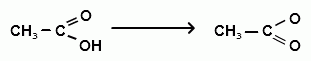 4. Образование этилацетата (характерный запах):
4. Образование этилацетата (характерный запах):
С2H5OH +
Испытания на чистоту. В субстанции проводят определение прозрачности и бесцветности жидкости, относительной плотности, оптической плотности в УФ-свете. Определение летучих примесей (высшие спирты, ацетальдегид, бензол, метанол, фурфурол и др.) проводят методом газовой хроматографии.
Количественное определение.
По ГФУ не проводится.
Возможные методы:
1. По относительной плотности (с помощью алкоголеметрических таблиц).
2. В фармацевтических препаратах определяют концентрацию спирта по температурным пределам перегонки.
3. Метод дихроматометрии (обратное титрование, индикатор – крахмал, параллельно проводят контрольный опыт); (s=1,5):
3 C2H5OH + 2 K2Cr2O7 + 16 HNO3 → 4Cr(NO3)3 + 3 CH3COOH + 4 KNO3 + 11 H2O
K2Cr2O7 + 6 KI + 14HNO3 → 8 KNO3 + 2 Cr(NO3) + 3 I2 + 7 H2O
I2 + 2 Na2S2O3 → 2NaI + Na2S4O6
Применение: наружно в качестве антисептического и раздражающего средства.
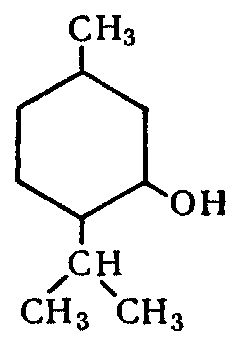 Ментол рацемический (Mentolum racemicum)
Ментол рацемический (Mentolum racemicum)
Ментол рацемический представляет собой смеси равных частей
(1RS,2RS,5RS)-(±)-5-Methyl-2-(1-methylethyl)cyclohexanol
Свойства. Бесцветные кристаллы с сильным запахом перечной мяты и холодящим вкусом. Летуч при обыкновенной температуре и перегоняется с водяным паром. При растирании препарата с равным количеством камфоры, хлоралгидрата, фенола, резорцина или тимола образуются жидкости. Очень мало растворим в воде, очень легко растворим в 95% спирте, эфире, уксусной кислоте, легко растворим в жидком парафине и жирных маслах. Температура плавления ─ 36-38 °C (311 K) рацемат, 42-45 °C (318 K) (−)-форма (α), 35-33-31 °C (−)-изомер. Удельное вращение от -49° до -51° (10% раствор в 95% спирте).
 Получение. 1. Промышленный синтез включает в себя стадию асимметрического гидрированя, разработанную Рёдзи Ноёри с сотрудниками:
Получение. 1. Промышленный синтез включает в себя стадию асимметрического гидрированя, разработанную Рёдзи Ноёри с сотрудниками:
2. Ментол встречается в эфирном масле перечной мяты в свободном состоянии и частично в виде эфира уксусной кислоты. Содержание ментола в эфирном масле зависит от сорта мяты и места произрастания.
Существуют такие методы выделения ментола из эфирного мятного масла как:
1) Боратный метод (разработанный Б. Н. Рутовским): используется для сортов масла с содержанием ментола 50-60 %. Эфирное масло нагревают с борной кислотой при пониженном давлении.
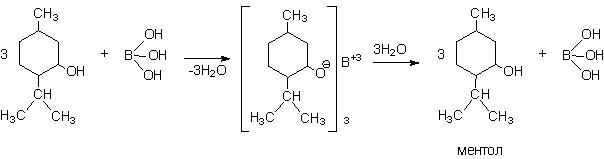
Полученный ментоловый эфир борной кислоты имеет высокую температуру кипения, что позволяет его отделить от других компонентов мятного масла. Затем при перегонке эфира с водяным паром в результате омыления получается ментол.
2) Метод вымораживания применим для эфирного масла с содержанием ментола до 80 %. При фракционной перегонку мятного масла выделяют фракцию, кипящую при 208 - 212ºС, при охлаждении ее до -20ºС выделяются кристаллы ментола.
3) Синтезировать ментол (рацемат) можно восстановлением тимола давлением в присутствии катализаторов.
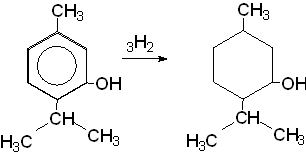
Идентификация.
1. Физико-химические методы: удельное оптическое вращение, ТХС, газовая хроматография (ГФУ).
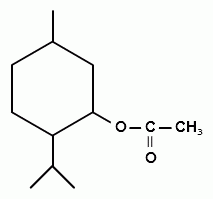
2. Реакция образования сложного эфира. При взаимодействии субстанции с динитробензоилхлоридом в пиридине, образуется осадок с характерной температурой плавления (ГФУ): 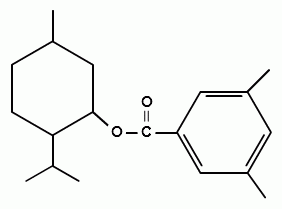
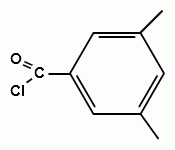
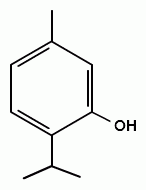
+ + НСl
3. При действии раствора ванилина в кислоте серной концентрированной наблюдается желтое окрашивание, которое при добавлении воды переходит в малиново-красное:
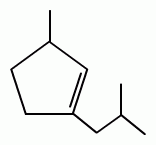
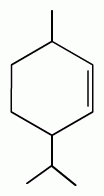

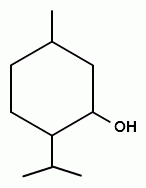
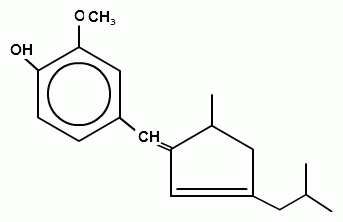
Количественное определение субстанции по монографии ГФУ не проводится.
Возможный метод: алкалиметрия после ацетилирования. Около 0,7 г препарата (точная навеска) помещают в колбу для ацетилирования, приливают туда же точно 10 мл раствора уксусного ангидрида в безводном пиридине. Нагревают в течение 2 часов на песчаной бане с обратным холодильником при слабом кипении жидкости. Затем прибавляют через холодильник 25 мл воды и после охлаждения титруют образовавшуюся уксусную кислоту 0,5 н. раствором едкого натра (индикатор - фенолфталеин). Параллельно проводят контрольный опыт при комнатной температуре; (s=1):

+ (CH3CO)2O + CH3COOH
(CH3COO)2O +H2O → 2 CH3COOH
CH3COOH + NaOH →CH3COONa + H2O
Применение: наружно как обезболивающее, слабое антисептическое средство при зудящих дерматозах, воспалительных процессах.
Вода очищенная (Aqua purificata)
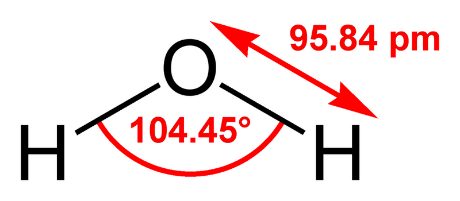
Описание. Бесцветная прозрачная жидкость без запаха и вкуса.
pH от 5,0 до 7,0 (к 100 мл воды прибавляют 0,3 мл насыщенного раствора калия хлорида и измеряют pH раствора потенциометрически, (ГФ XI, вып. 1, стр. 113).
Сухой остаток. 100 мл воды выпаривают на водяной бане досуха и сушат при (100 - 105) град. С до постоянной массы. Остаток не должен превышать 0,001%.
Испытания на чистоту.
Кислотность или основность. К 10 мл субстанции, только прокипячённой в пробирке с боросиликатного стекла и охлажденной, добавляют 0,05 мл раствора метилового красного Р; полученный раствор не должен окрашиваться в красный цвет.
К 10 мл субстанции добавляют 0,1 мл раствора бромтимолового синего Р1; раствор не должен окрашиваться в синий цвет.
Нитраты. Не более 0,00002%. 5 мл субстанции помещают в пробирку, погруженную в ледяную баню, добавляют 0,4 мл раствора 100 г/л калия хлорида Р, 0,1 мл раствора дифениламина р и каплями, при перемешивании, 5 мл кислоты серной, свободной от азота, Р. Затем пробирку переносят в водяную баню, нагретую до температуры 500С; через 15 мин голубое окрашивание испытуемого раствора должен быть не интенсивнее окраски эталона, приготовленного параллельно с испытуемым раствором с использованием смеси 4,5 мл воды, свободной от нитратов, Р и 0,5 мл эталонного раствора нитрата (2 ppm NO3) P.
Окисляющиеся вещества. К 100 мл субстанции добавляют 10 мл кислоты серной разведенной Р, 0,1 мл 0,02 М раствора калия перманганата и кипятят в течении 5 мин; раствор должен оставаться бледно-розовым.
Хлориды. К 10 мл субстанции добавляют 1 мл кислоты азотной разведенной Р и 0,2 мл раствора серебра нитрата Р2; в течении 15 мин не должно быть видимых изменений раствора.
Сульфаты. К 10 мл субстанции добавляют 0,1 мл кислоты хлористоводородной разведенной Р и 0,1 мл раствора бария хлорида Р1; в течении 1 часа не должно быть видимых изменений раствора.
Соли аммония. Не более 0,00002%. До20 мл субстанции добавляют 1 мл раствора калия тетрайодомеркурата щелочного Р; через 5 мин окраска полученного раствора должна быть не интенсивнее окраски эталона, приготовленного одновременно с испытуемым раствором добавлением 1 мл раствора калия тетрайодомеркурата щелочного Р к смеси 4 мл эталонного раствора аммония Р и 16 мл воды, свободной от аммиака Р.
Кальций и магний. К 100 мл субстанции добавляют 2 мл аммиачного буферного раствора рН 10,0 Р, 50 мг протравного черного 11 индикаторной смеси Р и 0,5 мо0,01 М раствора натрий эдетата; образуется сине-фиолетовая окраска.
Микробиологическая чистота. Должна соответствовать требованиям на питьевую воду (не более 100 микроорганизмов в 1 мл) при отсутствии бактерий сем. Enterobacteriaceae, Staphylococcus aureus, Pseudomonas aeruginosa. Испытания проводят в соответствии со статьей "Испытание на микробиологическую чистоту" (ГФ XI, вып. 2, стр. 193).
Хранение. Используют свежеприготовленной или хранят в закрытых емкостях, изготовленных из материалов, не изменяющих свойств воды и защищающих ее от инородных частиц и микробиологических загрязнений
Применение. Как растворить веществ и разбавитель субстанций.
Дата публикования: 2015-10-09; Прочитано: 5674 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
