 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Задание по работе. 1 Изучить процесс приготовления микрошлифов
|
|
1 Изучить процесс приготовления микрошлифов.
2 Изучить процесс травления микрошлифов.
3 Изучить устройство микроскопа и освоить приемы работы на нем. Зарисовать схему хода лучей в микроскопе.
4 Исследовать микрошлиф после травления и зарисовать структуру.
5 Определить цену деления окуляр-микрометра.
6 Определить величину зерна материала микрошлифа и установить его номер.
7 Составить письменный отчет о работе.
Лабораторная работа № 5. Построение диаграммы состояния методом термического анализа
Цель работы: изучение методики проведения термического анализа, приобретение практических навыков работы с оборудованием, построение диаграмм состояния.
Термический анализ является одним из методов определения температур фазовых превращений вещества, сопровождающихся тепловыми эффектами. Метод основан на построении кривых охлаждения (нагрева) в координатах « температура вещества – время охлаждения (нагрева) ». Если при охлаждении (нагревании) в веществе не происходят фазовые превращения кривая охлаждения имеет вид плавной нисходящей линии. При фазовых превращениях на кривой появляются горизонтальные (изотермические) участки или изгибы, обусловленные выделением (поглощением) тепла, вызывающем изменение скорости охлаждения (нагрева).
Процесс кристаллизации металлических сплавов и некоторые закономерности в их строении описываются с помощью диаграмм состояния или диаграмм фазового равновесия. Эти диаграммы в графической форме показывают фазовый состав и структуру в зависимости от температуры и концентрации. Они построены для условий равновесия. Равновесное состояние соответствует минимуму свободной энергии и в связи с этим является стабильным. При данных температуре и давлении в условиях равновесия свободная энергия должна оставаться постоянной.
Прежде, чем перейти к рассмотрению диаграмм состояния, дадим точные определения основным понятиям, которыми нам придется оперировать.
Фаза – это однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав, структура и свойства вещества изменяются скачком. Однородная жидкость является однофазной системой, смесь жидкости и твердого вещества – двухфазной, твердый раствор – однофазная система, механическая смесь двух твердых растворов – двухфазная система.
Компонентами называются вещества, образующие систему. Чистый металл – это однокомпонентная система, сплав двух металлов — двухкомпонентная.
Под числом степеней свободы системы понимается число внешних и внутренних факторов, которое можно изменять без изменения числа фаз в системе. К внешним факторам, влияющим на состояние сплава, относятся температура и давление, к внутренним – концентрация.
Общие закономерности существования устойчивых фаз, отвечающих теоретическим условиям равновесия, могут быть выражены в математической форме, именуемой правилом фаз или законом Гиббса.
Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз и выражается уравнением
С = К + 2 - Ф,
где С – число степеней свободы (или вариантность);
К – число компонентов, образующих систему;
Ф – число фаз, находящихся в равновесии;
2 – число внешних факторов.
Если число степеней равно нулю (нонвариантная система), то изменение факторов (температуры, давления, концентрации) будет приводить к изменению числа фаз.
При применении правила фаз к металлам можно считать изменяющимся только один внешний фактор – температуру, так как давление, за исключением очень высокого, мало влияет на число фаз металлических сплавов в твердом и жидком состоянии. Тогда уравнение примет следующий вид:
С = К + 1 - Ф.
Число степеней свободы системы не может быть меньше нуля и не может быть дробным числом.
К - Ф +1 ³ 0,
тогда Ф £ К + 1, т. е. число фаз в сплаве, находящемся в равновесии, не может быть больше, чем число компонентов плюс единица.
Следовательно, в двухкомпонентной системе в равновесии может находиться не более 3-х фаз, в трехкомпонентной – 4-х. Если в равновесии находится максимальное число фаз, то число степеней свободы системы равно нулю (С = 0). Такое равновесие называется нонвариантным (безвариантным).
При нонвариантном равновесии сплав может существовать только в совершенно определенных условиях: при t = const и определенном составе всех фаз, находящихся в равновесии. Это означает, что превращение начинается и заканчивается при определенной температуре. Например, чистый металл при затвердевании состоит из двух фаз – твердой и жидкой одинакового состава. В этом случае система нонвариантна, так как С = 1 + 1 – 2 = 0, т. е. процесс кристаллизации будет протекать при t = const.
Сплав из двух компонентов при затвердевании, допустим, состоит из двух фаз. В этом случае С = 2 + 1 – 2 = 1 (это значит, что процесс кристаллизации может протекать при переменной температуре) – следовательно температуру в данном случае можно изменять без изменения числа фаз.
Диаграмма состояния строится в координатных осях, по которым откладывают температуру (в градусах Цельсия) и массовую долю компонентов (от 100 % одного до 100 % другого). Линии на диаграмме являются геометрическим местом критических температур, под которыми понимаются температуры фазовых превращений. Для их определения строят кривые охлаждения для сплавов различного состава и по остановкам и перегибам на этих кривых определяют температуры превращений – критические точки.
Схема установки для термического анализа приведена на рисунке 5.1.

Рисунок 5.1 – Схема установки для исследования процесса кристаллизации сплавов методом термического анализа
В печь 1 помещают тигель 2 с исследуемым сплавом. Сплав расплавляют и опускают в него горячий спай термопары 3, защищенной фарфоровым или кварцевым чехлом 4. Печь выключают, и начинается охлаждение сплава. К холодным концам 5 термопары протекает электрический ток, возникающий из-за разности потенциалов в горячем спае. Ток по компенсационным проводам 6 идет к гальванометру 7, шкала которого проградуирована в градусах Цельсия. Сила тока в термопаре пропорциональна температуре сплава. Через определенные короткие равные отрезки времени фиксируют температуру и записывают в таблицу. После полного охлаждения сплава строят график « температура – время » (кривая охлаждения).
Рассмотрим конкретный пример построения диаграммы состояния системы « олово – цинк » (рисунок 5.2). Термическому анализу подвергают ряд сплавов системы, включая и чистые компоненты. При охлаждении расплавленного олова (рисунок 5.2, а) первоначально наблюдается монотонное понижение температуры во времени (участок 0-1 на кривой охлаждения а). Расчет правила фаз (С = К – Ф + 1 = 1 – 1 + 1 = 1) подтверждает моновариантность системы (можно менять температуру, не нарушая фазового равновесия). При 232 °С понижение температуры прекращается. Горизонтальная площадка на кривой охлаждения свидетельствует о переходе олова из жидкого состояния в твердое (кристаллизация). В процессе кристаллизации, протекающей в течение периода времени 1-1′, потери теплоты в окружающую среду при охлаждении сплава компенсируются выделяющейся теплотой кристаллизации, поэтому температура на отрезке 1-1′ остается постоянной. Правомерность наличия горизонтальной площадки на кривой охлаждения подтверждается правилом фаз (С = К – Ф + 1 = 1 – 2 + 1 = 0). Система безвариантна (нонвариантна) и до тех пор, пока

a – 100 % Sn,; б – 4% Zn + 96% Sn; в – 9% Zn + 91% Sn; д – 60% Zn + 40% Sn; е – 100% Zn
Рисунок 5.2 – Диаграмма состояния сплавов системы Sn-Zn (г) и кривые охлаждения
идет кристаллизация, не имеет ни одной степени свободы (температуру нельзя менять, иначе нарушится фазовое равновесие и изменится число фаз). В точке 1′ кристаллизация заканчивается, и при дальнейшем понижении температуры происходит охлаждение уже закристаллизовавшегося олова (С = 1). Микроанализ выявляет однородную равновесную поликристаллическую структуру металла. Кривая охлаждения цинка (см. рисунок 5.2, е) имеет аналогичный характер и отличается лишь температурным уровнем площадки (418 °С).
Полученные критические точки кристаллизации олова и цинка переносят с кривых охлаждения на график (см. рисунок 5.2, г ) « температура - содержание компонентов » (точка, соответствующая периоду 1-1′ для 100 % Sn с кривой охлаждения а, и точка 1, 1′ для 100 % Zn с кривой охлаждения е).
Кристаллизация сплава, содержащего 4 % Zn и 96 % Sn, начинается при более низкой температуре (см. рисунок 5.2, б), чем кристаллизация чистого олова, и первоначально (от точки 1 до точки 2) характеризуется лишь изменением скорости охлаждения (перегиб кривой), что подтверждается правилом фаз (С = К - Ф + 1 = 2 – 2 + 1 = 1). Как показывают микроанализ и химический анализ, кристаллы, выпадающие из жидкости в интервале температур
1 – 2, представляют собой чистое олово. Выделение олова и рост его кристаллов при охлаждении от точки 1 до точки 2 вызывает обеднение жидкой части сплава оловом и соответственно обогащение цинком. Как только достигается соотношение 9 % Zn и 91 % Sn, выделение и рост кристаллов олова прекращаются, а жидкая часть сплава кристаллизуется в виде смеси мелких кристаллов Sn и Zn (эвтектики). Такая одновременная кристаллизация двух фаз называется эвтектической и обычно изображается следующим образом:
ЖС 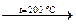 Э (Sn + Zn).
Э (Sn + Zn).
Эта реакция читается так: жидкость состава точки С при t =200 °С кристаллизуется в виде эвтектики (олово плюс цинк).
В период эвтектического превращения в равновесии одновременно находятся три фазы: жидкая и эвтектические кристаллы Sn и Zn, поэтому С = 2 – 3 + 1= 0. Система нонвариантна. Ниже точки 2' никаких фазовых превращений не происходит, и сплав состоит из кристаллов Sn и эвтектики (С = 1). Система моновариантна, что свидетельствует о возможности изменения либо температуры, либо содержания компонентов (температура является зависимой переменной) без нарушения фазового равновесия.
Сплав, содержащий 9 % Zn и 91 % Sn (см. рисунок 5.2, в), имеет строго эвтектический состав, предельно насыщен обоими компонентами, поэтому кристаллизация его происходит при постоянной температуре (t = 200 °С). Этот сплав называют эвтектическим.
У сплава, содержащего 60 % Zn и 40 % Sn (см. рисунок 5.2, д ), кривая охлаждения подобна кривой, приведенной на рисунке 5.2, б. Принципиальное отличие первой заключается в том, что в данном случае эвтектическому превращению предшествует выделение кристаллов избыточного цинка.
Соединив на графике « температура – концентрация » критические точки начала кристаллизации сплавов, получим линию ликвидус АСВ, а точки конца кристаллизации образуют линию солидус DCF (см. рисунок 5.2, г). В целом это и есть диаграмма состояния системы « олово – цинк ». Линия ликвидус показывает температуру начала кристаллизации при охлаждении или окончания плавления при нагреве сплавов; линия солидус – температуру окончания кристаллизации сплавов. Ниже линии солидус сплавы находятся в твердом состоянии. Она показывает окончание их кристаллизации и начало плавления (соответственно). Все сплавы системы Sn-Zn делятся эвтектическим сплавом на доэвтектические и заэвтектические. Доэвтектические сплавы состоят из кристаллов олова и эвтектики, эвтектические – из эвтектики, заэвтектические – из кристаллов цинка и эвтектики.
Дата публикования: 2015-10-09; Прочитано: 589 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
