 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Растворы неэлектролитов и электролитов
|
|
Вариант 2
1. В растворе объёмом 250 мл содержится сульфат алюминия массой 7,5 г. Чему равна молярная концентрация и молярная концентрация эквивалента этого раствора?
2. Можно ли осуществить следующие реакции:
BaCO3¯ + CaCl2 ® CaCO3¯ + BaCl2
AgI¯ + KBr ® AgBr¯ + KI
3. Раствор циановодорода HCN имеет рН < 7. Постепенно в него добавляют цианид калия и констатируют, что среда становится менее кислой, затем нейтральной и, наконец, щелочной (рН < 7). Объясните результаты опыта.
4. Раствор, содержащий 2,1 г КОН в 250 мл воды, замерзает при –0,519°С. Найдите для этого раствора изотонический коэффициент. Криоскопическая постоянная воды К=1,86.
5. Какая из солей в большей степени подвергается гидролизу (при одинаковой концентрации растворов): NH4Cl; СH3COONa; K2S; Rb2CO3? Почему? Напишите молекулярное и ионные уравнения гидролиза Rb2CO3 по первой ступени.
6. Вычислите рН раствора 0,1М уксусной кислоты, если степень диссоциации составляет 1%.
Контрольная работа 2
Растворы неэлектролитов и электролитов
Вариант 3
1. Какой объём 10% – ного раствора гидроксида калия (r = 1,08 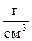 ) можно приготовить из 15 г КОН?
) можно приготовить из 15 г КОН?
2. Определите рОН и рН раствора, в котором концентрация гидроксид-ионов равна 1,5×10-9 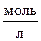 .
.
3. К насыщенному раствору AgBr, находящемуся в равновесии с осадком, добавили раствор NaCl. Какие явления будут наблюдаться? Почему?
4. При какой концентрации раствора степень диссоциации азотистой кислоты HNO2 будет равна 0,2?
5. В растворе каких солей краснеет лакмусовая бумажка: KCl; ZnSO4; Cu(NO3)2; K2CO3? Напишете молекулярное и ионно-молекулярное уравнения гидролиза соли Cu(NO3)2.
6. Температура кристаллизации одномолярных растворов циановодорода HCN и глюкозы C6H12O6 близки. Какой вывод можно сделать относительно степени диссоциации HCN: а) a близка к 1; б) a близка к 0? Почему?
Дата публикования: 2015-10-09; Прочитано: 708 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
