 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Контрольная работа 1. Химическая термодинамика
|
|
Химическая термодинамика. Химическая кинетика и равновесие
Вариант 3
1. В каких случаях возможно самопроизвольное протекание химических реакций при стандартных условиях, если принять ½DH°½>>½TDS°½?
2. Восстановление диоксида свинца водородом протекает по уравнению:
PbO2 (кр) + H2 (г) ® PbO (кр) + H2O (ж); ΔrH˚298 = -182,8 кДж
Определите стандартную теплоту образования PbO2.
3. Рассчитайте ΔrS˚298 реакции разложения бертолетовой соли, если:
S˚298(KClO3) = 142,97 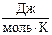 ,
,
S˚298(KCl) = 82,68 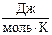 .
.
4. Даны следующие системы:
С (гр) + Н2О (г) «СО (г) + Н2 (г); ΔrH = 131,4 кДж
Н2 (г) + Cl2 (г) «2HCl (г); ΔrH = -175,7 кДж
РCl5 (г) «PCl3 (г) + Cl2 (г) + Q
CO (г) + Сl2 (г) «СOCl2 (г) – 109,6 кДж
Укажите, какая из систем (1) – (4) является гомогенной? Для каких из реакций (1) – (4) равновесие сместится влево при повышении температуры?
5. Вычислите энергию активации реакции разложения диоксида азота: 2NO2® 2NO + O2,
если константы скорости реакции при 600 и 640 К соответственно равны 83,9 и 407,0 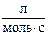 .
.
6. Во сколько раз увеличится скорость реакции, протекающей в газовой фазе, при повышении температуры от 30 до 70 °С, если температурный коэффициент реакции равен 2?
Дата публикования: 2015-10-09; Прочитано: 733 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
