 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Строение атома, периодический закон и Периодическая система Д.И. Менделеева
|
|
1.(20). Знает названия, обозначения, заряд и относительную массу частиц, входящих в состав атома.
2.(21). Объясняет, чем отличаются изотопы одного и того же химического элемента, записывает символы изотопов, вычисляет атомную массу химического элемента по его изотопному составу.
3.(22). Понимает теоретические основы (принцип квантования, корпускулярно-волновая двойственность, принцип неопределенности) и знает экспериментальные факты, на которых основана современная модель строения атома.
4.(23). Объясняет понятие «атомная орбиталь» и знает наглядные формы её представления, изображает формы граничной поверхности s-, p- и d-орбиталей.
5.(24). Знает квантовые числа: названия, обозначения, физический смысл, взаимосвязь.
6.(25). Знает закономерности формирования электронных оболочек многоэлектронных атомов: принцип наименьшей энергии, правила Клечковского, принцип Паули, правило Хунда.
7.(26). Записывает электронную формулу атома по атомному номеру элемента и указывает валентные электроны; для валентных электронов умеет записывать графическую формулу.
8.(27). Определяет значения квантовых чисел для любого электрона в атоме.
9.(28). Знает формулировку периодического закона, структуру основных форм Периодической системы (8- и 18-клеточной), разделение элементов на семейства s-, p-, d- и f-элементов.
10.(29). Объясняет физический смысл атомного номера, периода и группы, знает отличия побочной подгруппы от главной в 8-клеточной форме периодической системы.
11.(30). Знает и объясняет закономерности изменения в периодах и группах характеристик атомов (радиус и ионизационный потенциал) и свойств элементов и простых веществ (металлические и неметаллические свойства, электроотрицательность, окислительно-восстановительные свойства).
12.(31). Объясняет по электронному строению атома и месту элемента в периодической системе химические свойства элемента, а также состав и свойства его оксидов и гидроксидов.
Тема 5. Химическая связь и строение вещества
1.(32). Объясняет содержание основных характеристик химической связи (длина, энергия, валентный угол, дипольный момент) и закономерности изменения длины и энергии связи в однотипных молекулах: неорганических (HF–HCl––HBr–HI, H2O–H2S–H2Se–H2Te) и органических (C2H6–C2H4–C2H2).
2.(33). Объясняет причину образования ковалентной связи и её свойства (направленность, насыщаемость, полярность, неполярность).
3.(34). Изображает схемами метода валентных связей обменный механизм образования химической связи в молекулах H2, N2, F2, HF, H2O, H2O2, NH3, CO2.
4.(35). Различает в молекулах N2 и CO2 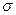 -связь и
-связь и 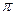 -связь, определяет в них кратность химической связи; на примере молекул C2H6–C2H4–C2H2 и H2–N2 объясняет влияние кратности связи на ее энергию.
-связь, определяет в них кратность химической связи; на примере молекул C2H6–C2H4–C2H2 и H2–N2 объясняет влияние кратности связи на ее энергию.
5.(36). Знает простейшие молекулы (CO) и ионы (NH  ), в которых химическая связь образуется по донорно-акцепторному механизму; определяет в них степень окисления, стехиометрическую и электронную валентность элементов.
), в которых химическая связь образуется по донорно-акцепторному механизму; определяет в них степень окисления, стехиометрическую и электронную валентность элементов.
6.(37). Знает и иллюстрирует примерами основные типы гибридизации (sp, sp2, sp3, sp3d2); определяет тип гибридизации по геометрическому строению молекулы (иона) и значению валентного угла и, наоборот, знает геометрическое строение молекул (ионов), соответствующее определённому типу гибридизации (при отсутствии несвязывающих орбиталей).
7.(38). Объясняет влияние несвязывающих орбиталей на строение молекул.
8.(39). Объясняет методом молекулярных орбиталей образование и свойства двухатомных молекул, содержащих элементы первого и второго периодов периодической системы.
9.(40). Объясняет природу ионной связи; знать, между какими элементами она возникает и как она влияет на свойства веществ; объясняет закономерность изменения степени ионности в рядах однотипных соединений.
10.(41). Объясняет металлическую связь и её свойства теорией электронного газа.
11.(42). Знает, между какими молекулами образуется водородная связь и как она влияет на свойства соединений (температуру и энтальпию кипения, растворимость).
12.(43). Знает, между какими молекулами имеет место ориентационное, индукционное и дисперсионное взаимодействия и как они влияют на свойства соединений.
13.(44). Знает агрегатные состояния вещества (твердое, жидкое, газ, плазма) и как они отличаются по виду частиц и энергии связи между ними.
14.(45). Для твердого состояния знает классификацию кристаллов по виду частиц в узлах кристаллической решетки и типу взаимодействия межу ними (атомные, ионные, металлические, молекулярные) и характерные физико-химические свойства веществ с тем или иным типом кристаллов.
РАЗДЕЛ II. ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ РЕАКЦИЙ
Тема 6. Основы химической термодинамики
1.(46). Знает предмет химической термодинамики и параметры стандартного состояния, объясняет понятие «химическая система» и знает типы систем.
2.(47). Знает классификацию реакций в химической термодинамике (экзотермические и эндотермические, изохорные и изобарные, самопроизвольные и несамопроизвольные).
3.(48). Объясняет понятия внутренней энергии и энтальпии системы (вещества) и знает их взаимосвязь.
4.(49). Умеет записывать термохимические уравнения реакций, знать их особенности.
5.(50). Определяет, не проводя вычислений, тип реакции (экзотермическая или эндотермическая) при известном и неизвестном значении энтальпии этой реакции.
6.(51). Знает определение понятия «стандартная энтальпия образования вещества»; умеет вычислять её, если известны масса (объем – для газа) простого вещества, взаимодействующего без остатка с другим простым веществом, и количество выделяющегося при этом тепла.
7.(52). По энтальпии образования вещества вычисляет количество тепла, которое выделяется или поглощается при получении любой массы (объема – для газа) этого вещества.
8.(53). Знает закон Гесса; вычисляет энтальпию реакции по следствию закона Гесса.
9.(54). Вычисляет количество тепла, которое выделяется или поглощается при получении известной массы (объема – для газа) продукта или при израсходовании известной массы или объема (для газов) реагента.
10.(55). Объясняет физико-химический смысл энтропии системы и стандартной энтропии вещества; определяет по уравнению реакции, не проводя расчетов, как изменяется энтропия (увеличивается, уменьшается) при её протекании.
11.(56). Вычисляет энтропию реакции и по полученному результату определяет направление её протекания в изолированной системе.
12.(57). Вычисляет энергию Гиббса химической реакции при стандартной и нестандартной температуре и делает выводы о возможности и направлении её самопроизвольного протекания в неизолированной закрытой системе.
13.(58). Определяет, не проводя вычислений, направление реакции по знакам энтальпии и энтропии этой реакции.
14.(59). Сравнивает термодинамическую устойчивость соединений по справочным значениям их стандартной энергии Гиббса образования.
Тема 7. Химическое равновесие
1.(60). Знает термодинамические признаки химического равновесия; объясняет состояние равновесия с позиций химической кинетики, приводит примеры обратимых реакций.
2.(61) Записывает выражение закона действующих масс для равновесия обратимых гомо- и гетерогенных реакций.
3.(62). Вычисляет исходную концентрацию реагентов при известных равновесных концентрациях реагентов и продуктов; вычисляет равновесную концентрацию всех веществ при известной исходной концентрации реагентов и степени их превращения в продукты.
4.(63). Вычисляет константу равновесия при известных равновесных концентрациях реагентов и продуктов или вычисленных по п. 3.
5.(64). Вычисляет температуру, при которой константа равновесия равна единице.
6.(65). Устанавливает по принципу Ле Шателье направление смещения химического равновесия при изменении условий проведения реакции.
Тема 8. Основы химической кинетики
1.(66). Объясняет предмет химической кинетики и его отличие от предмета химической термодинамики.
2.(67). Знает принципы классификации реакций на гомогенные и гетерогенные; простые и сложные; последовательные, параллельные и цепные; моно-, би- и тримолекулярные; приводит примеры соответствующих реакций.
3.(68). Знает закон действующих масс для скорости реакций, записывает кинетические уравнения реакций; различает кинетический порядок и молекулярность реакции.
4.(69). Устанавливает кинетический порядок реакции по зависимости её скорости от концентрации реагентов, вычисляет константу скорости реакции по данным о зависимости её скорости от концентрации реагентов.
5.(70). Объясняет физический смысл энергии активации и причину увеличения скорости реакции при повышении температуры; знает правило Вант-Гоффа и уравнение Аррениуса, проводит по ним прямые и обратные расчёты.
6.(71). Объясняет сущность катализа, приводит примеры каталитических реакций, вычисляет увеличение скорости или константы скорости реакции при использовании катализаторов (при известных значениях энергии активации реакции без катализатора и при использовании катализатора).
РАЗДЕЛ III. РАСТВОРЫ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Тема 9. Способы выражения концентрации растворов
1.(72). Знает названия, обозначения, определения и соответствующие определениям формулы шести способов выражения концентрации растворов: массовая доля, молярная, эквивалентная, титр, моляльность и мольная доля.
2.(73). Проводит расчеты на переход от одного способа выражения концентрации к другому.
3.(74). Проводит расчеты параметров раствора (концентрация, масса, объем, плотность), полученного методом растворения чистого вещества (твердого, жидкого, газообразного), разбавления водой данного раствора или выпариванием воды из раствора.
4.(75). Вычисляет концентрацию раствора, получаемого смешиванием двух растворов с известной концентрацией.
5.(76). Вычисляет массу вещества или объем раствора, необходимые для проведения реакции с другим раствором и массу (объем) вещества полученную при проведении данной реакции.
6.(77). Знает закон эквивалентов для реакций в растворах, вычисляет концентрацию раствора кислоты или щёлочи по результатам основно-кислотного титрования.
7.(78). Проводит вычисления, связанные с коэффициентом растворимости вещества.
Тема 10. Образование и свойства растворов
1.(79). Знает сущность химической теории растворения, проводит вычисления, связанные с энтальпией растворения и гидратацией вещества.
2.(80). Приводит примеры растворов неэлектролитов, умеет вычислять свойства растворов неэлектролитов: понижение давления пара, повышение и понижение температур кипения и замерзания, осмотическое давление.
3.(81). Вычисляет молекулярную массу неэлектролита по температурам кипения и замерзания его раствора.
4.(82). Приводит примеры растворов электролитов, объясняет механизм их электролитической диссоциации, записывает схемы диссоциации кислот, оснований, солей (средних, кислых, основных).
5.(83). Объясняет смысл константы и степени диссоциации электролита, умеет записывать выражения для константы диссоциации слабых электролитов.
6.(84). Знает закон разбавления Оствальда и проводит по нему расчеты.
7.(85). Вычисляет водородный показатель растворов сильных и слабых электролитов.
8.(86). По справочным значениям произведения растворимости вычисляет концентрацию насыщенного раствора данного малорастворимого вещества и объем воды, необходимый для растворения данной массы малорастворимого вещества.
Тема 11. Реакции в растворах электролитов
1.(87). Записывает в молекулярном и ионном виде уравнения ионообменных реакций с участием и образованием нерастворимого вещества, газа, слабого электролита, перевода кислых и основных солей в нормальные.
2.(88). Устанавливает направление ионообменной реакции, если в левой и правой частях её уравнения имеются нерастворимые вещества или слабые электролиты.
3.(89). Определяет по формуле соли тип её гидролиза и среду её раствора.
4.(90). Записывает молекулярные и ионные уравнения гидролиза солей.
5.(91). Сравнивает соли по полноте их гидролиза (без расчетов).
6.(92). Устанавливает, что происходит с гидролизом данной соли (усиление, ослабление, изменений нет) при разбавлении раствора и введении в её раствор других веществ.
7.(93). Вычисляет водородный показатель раствора соли, если известна концентрация H+- или OH–-ионов в этом растворе; вычисляет концентрацию H+- и OH–-ионов в растворах солей, если известен водородный показатель этих растворов.
Тема 12. Электрохимические процессы
1.(94). Объясняет физико-химический смысл электродного потенциала металла, знает свойства ряда напряжений и его условного разделения на три части, знает приблизительное расположение наиболее известных металлов (Na, Mg, Al, Zn, Fe, Cu, Au) в ряду напряжений.
2.(95). Записывает электрохимические схемы гальванических и концентрационных элементов, катодные и анодные полуреакции и токообразующие реакции.
3.(96). Вычисляет ЭДС гальванических и концентрационных элементов при стандартных и нестандартных условиях.
4.(97). Записывает катодные и анодные полуреакции и суммарные реакции электролиза расплавов и растворов солей в электролизёре с инертным и активным анодом.
5.(98). Проводит количественные расчеты процессов электролиза по законам Фарадея.
6.(99). Приводит примеры и описывает применение электролиза в химической промышленности (получение водорода и щелочей), в металлургии (получение и рафинирования металлов) и при нанесении покрытий.
7.(100). Знает закономерности протекания электрохимической коррозии металлов и способы их защиты от коррозии.
Утверждено на заседании кафедры «Общая и неорганическая химия»
25 марта 2012 г.
Дата публикования: 2015-10-09; Прочитано: 181 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
