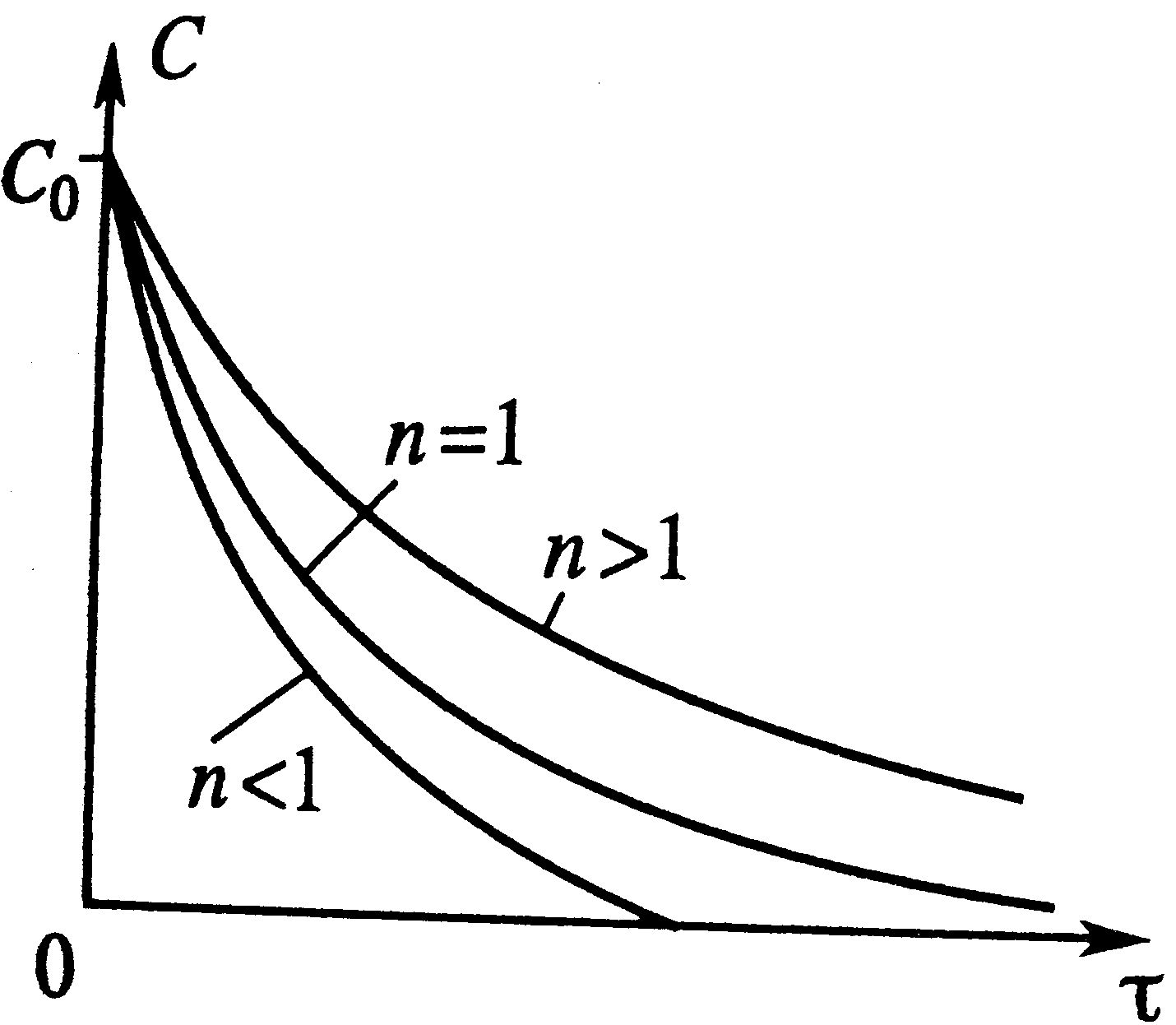
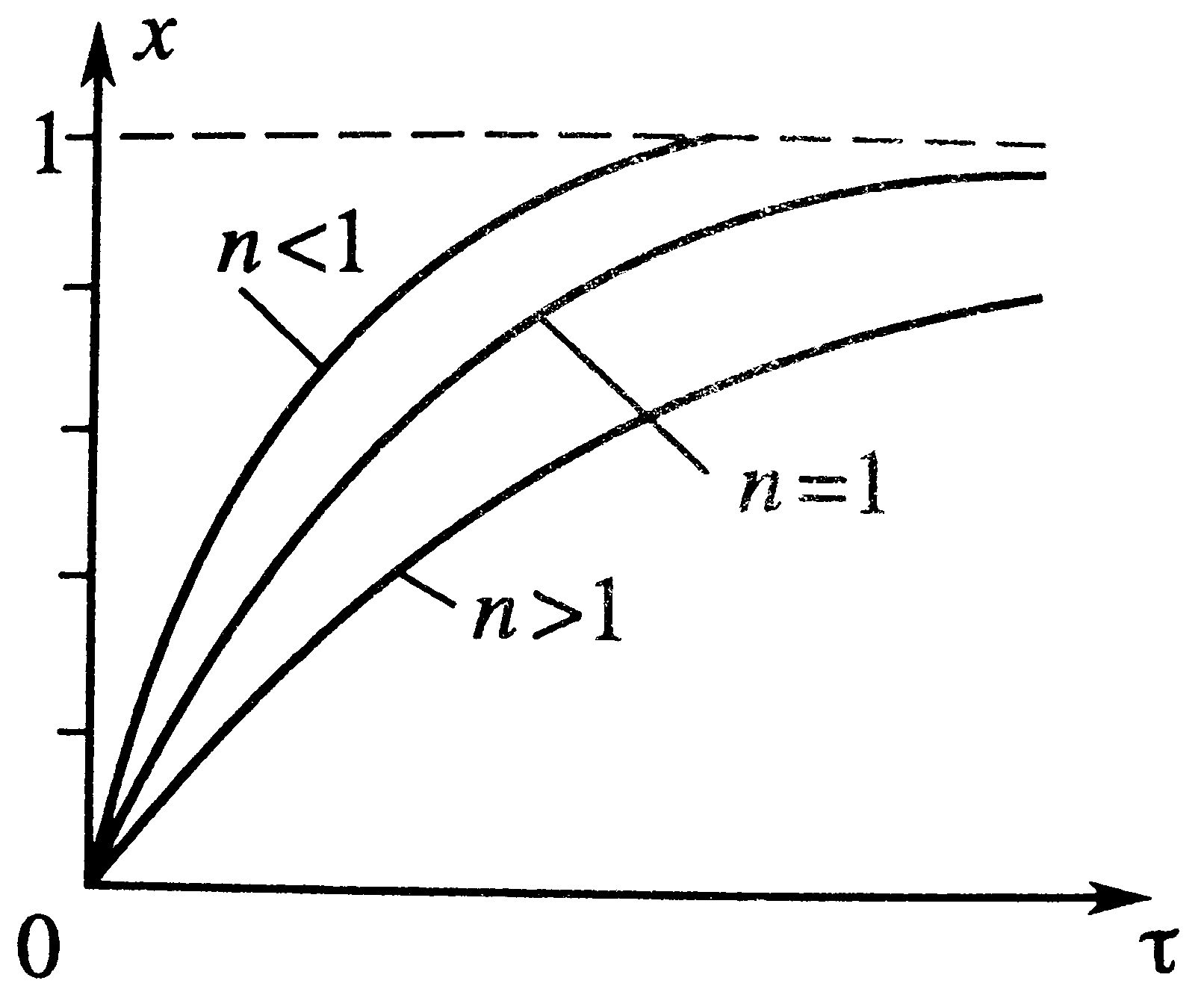
 Изотермический процесс РИС-п: Описывается уравнениями dC/dt=W(C), C=C0, при t=0 – астрономическое время. t=τ.
Изотермический процесс РИС-п: Описывается уравнениями dC/dt=W(C), C=C0, при t=0 – астрономическое время. t=τ.
Для реакции n-го порядка: скорость описывается W(C)=-kCn, dC/dτ=-kCn, dx/dt=kC0n-1(1-x)n. После интегрирования С=[C01-n-(1-n)kτ]1/(1-n). Отсюда видно что с увеличением τ концентрация уменьшается, т.е. вещество расходуется, х = (С0-С)/С0 – растет.
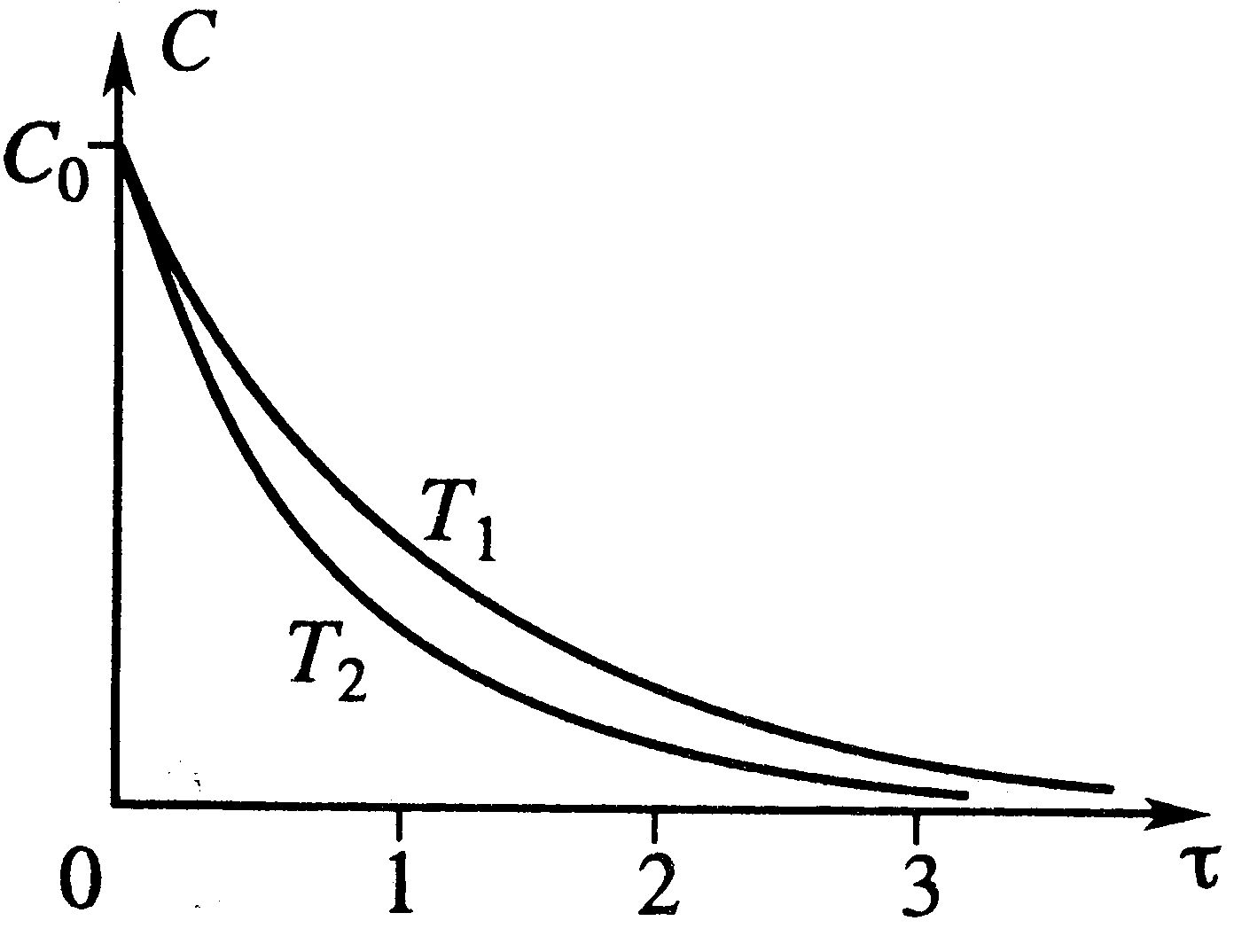
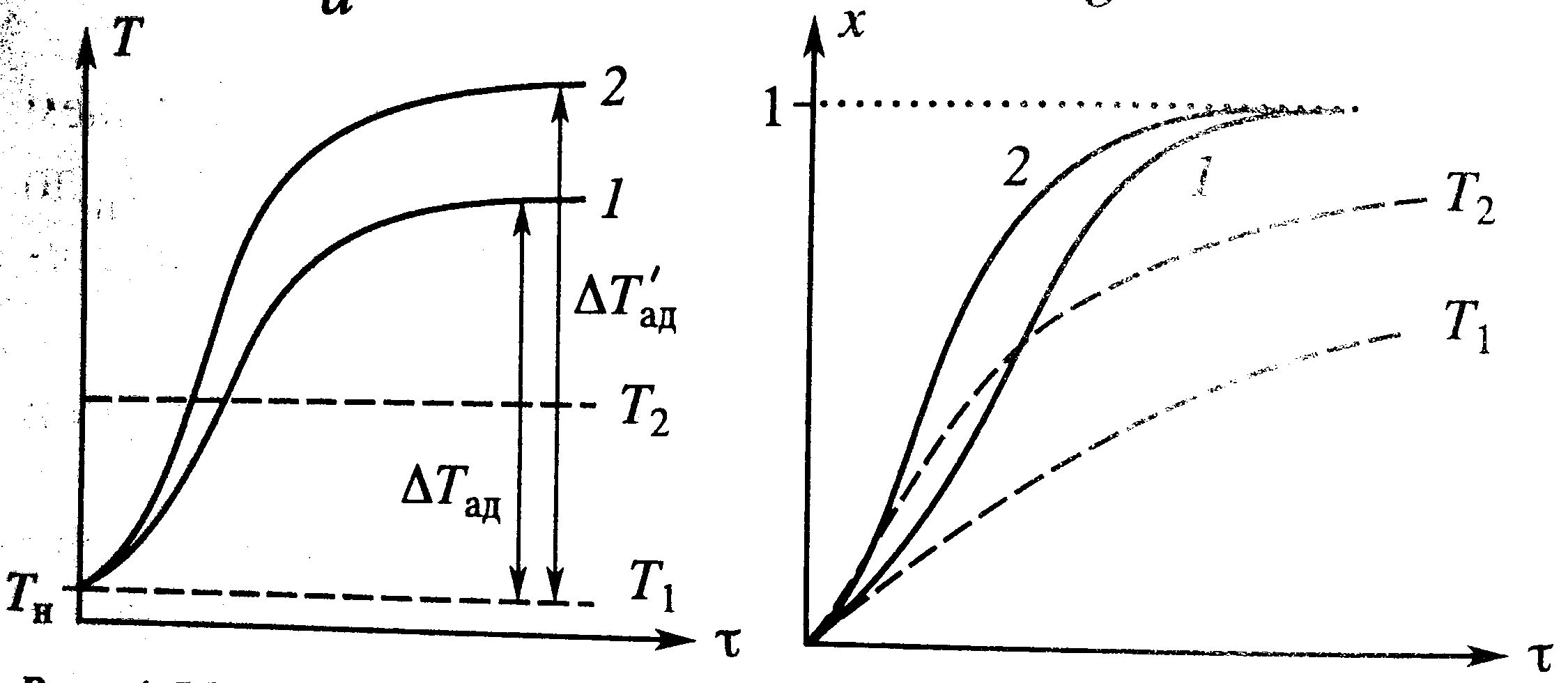
Влияние температуры: От температуры зависит только k – константа скорости k=k0e-E/RT, Т растет и k растет. При протекании простой необратимой реакции с ростом Т уменьшается τ. Для графика Т2>T1.
Простая обратимая реакция А↔R: Скорость реакции r(C)=k1CA-k2CR. Нужно использовать два уравнения вида dC/dt=W(C), удобно перейти к одной переменной хА: СА=С0(1-х), СR=C0х, где C0 – исходная конц. А. Модель процесса: dx/dτ=k1(1-x)-k2x, x=0 при τ=0. Преобразуем в dx/dτ=k1-(k1+k2)x и проинтегрируем
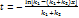 
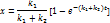
|
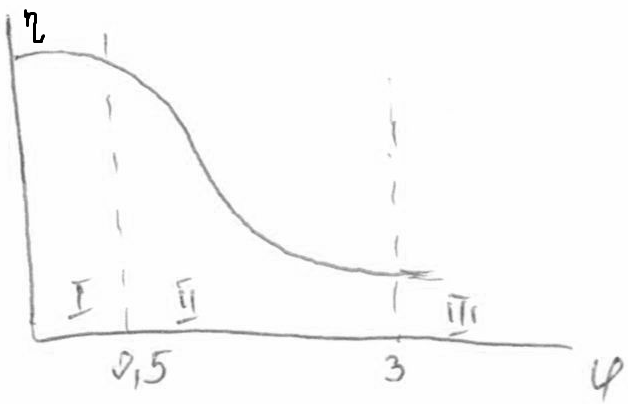
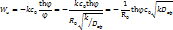 Степень использования внутренней поверхности - отношение
Степень использования внутренней поверхности - отношение  в зерне катализатора к W( в зерне катализатора к W( ) на поверхности. ) на поверхности.
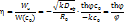
 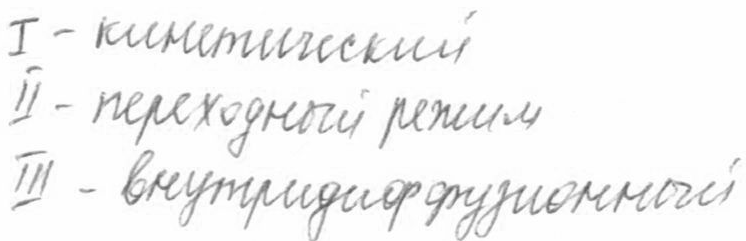
| 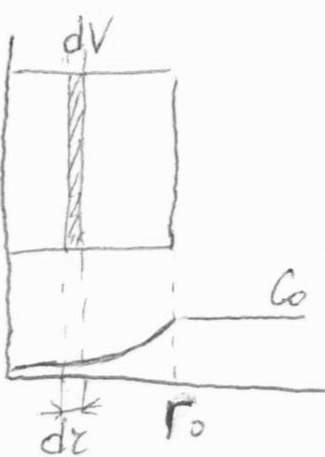 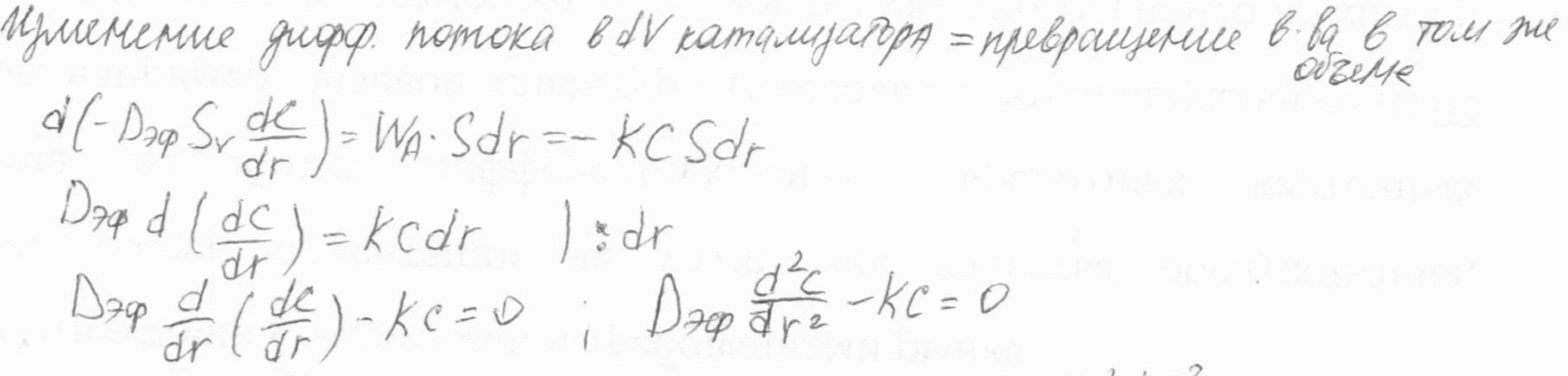 Безразмерный радиус
Безразмерный радиус 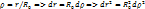 ; ;
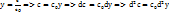 ; ;
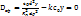 делим на делим на 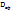 умножаем на умножаем на 
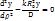
|
| 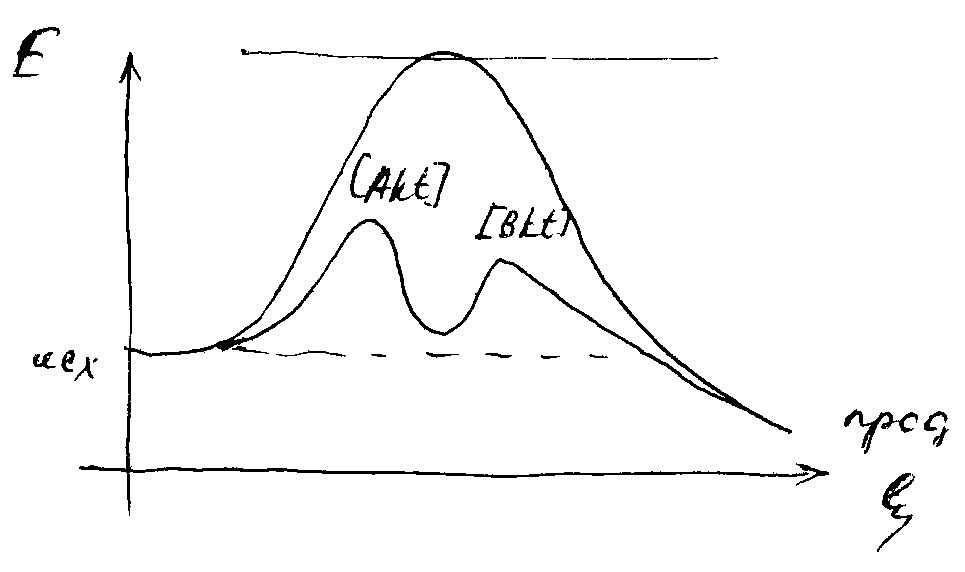 Катализатор не изменяет равновесие в системе, а направляет процесс по другому пути, с образованием промежуточных продуктов с более низкими энергиями активации. Т.е. не только ускоряет реакцию, но может служить методом управления направленности процессов.
Катализатор не изменяет равновесие в системе, а направляет процесс по другому пути, с образованием промежуточных продуктов с более низкими энергиями активации. Т.е. не только ускоряет реакцию, но может служить методом управления направленности процессов.
|
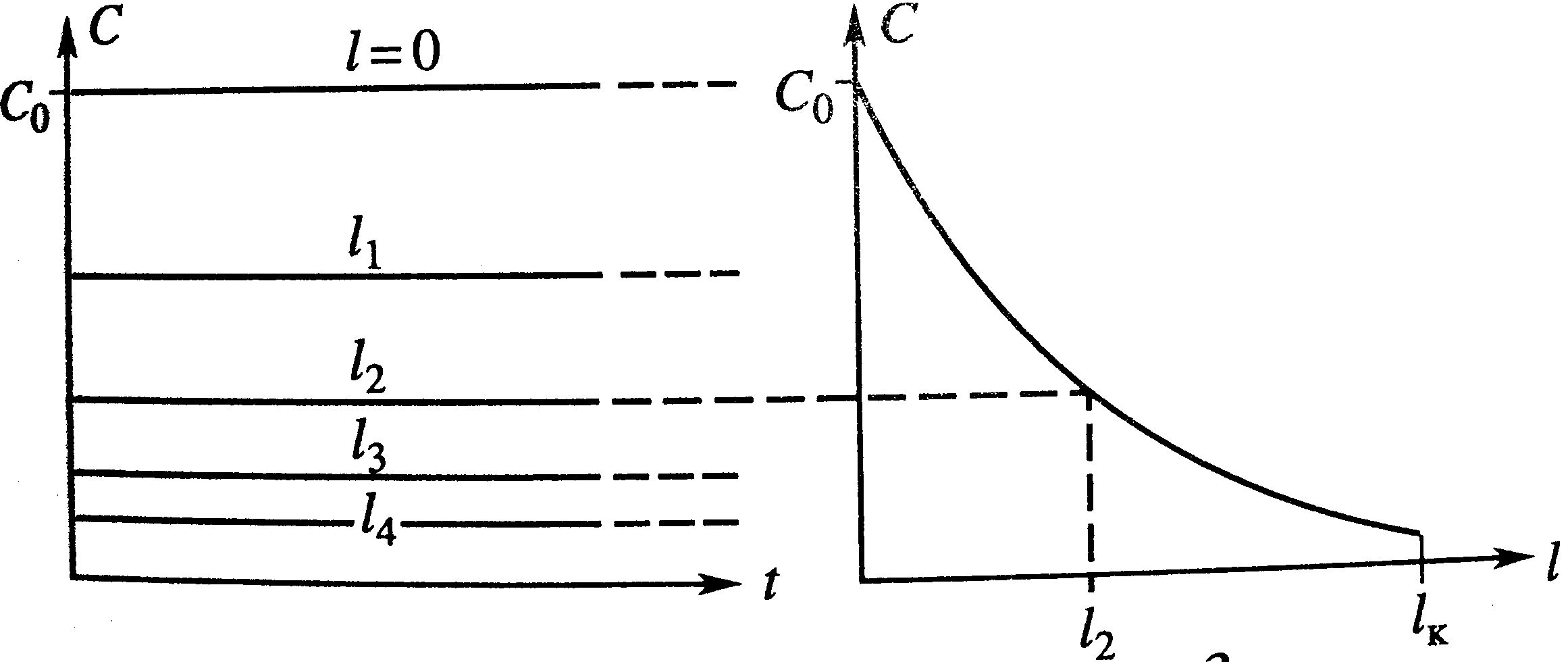 Изотермический процесс РИВ: все также как и в РИС-п, только в режиме ИВ процесс протекает стационарно. Концентрация С меняется по длине реактора. Изотермический процесс РИВ: все также как и в РИС-п, только в режиме ИВ процесс протекает стационарно. Концентрация С меняется по длине реактора.
| Простая необратимая реакция А→В, для это реакции скорость превращения W(C)=-kC; мат.модель: dC/dτ=-kC. Интегрируем и получаем ln(C/C0)=-kτ или С=С0е-kτ или τ=(1/k)ln(C/C0).
Через степень превращения х: С=С0(1-х), dx/dτ=k(1-x), x=0 при τ=0, решение этого уравнения τ=(1/k)ln(1/(1-х)) и х=1-е-kτ.
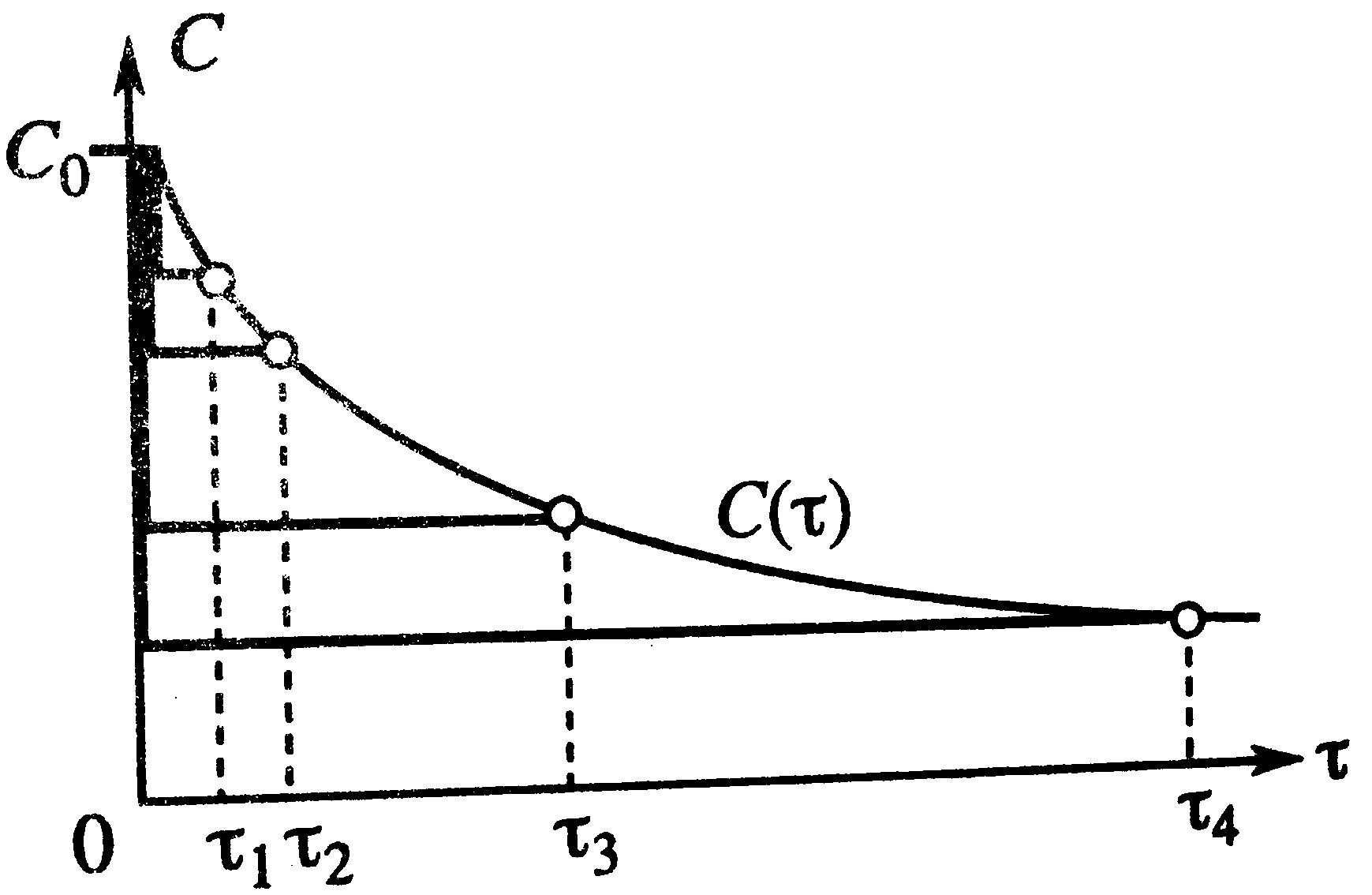
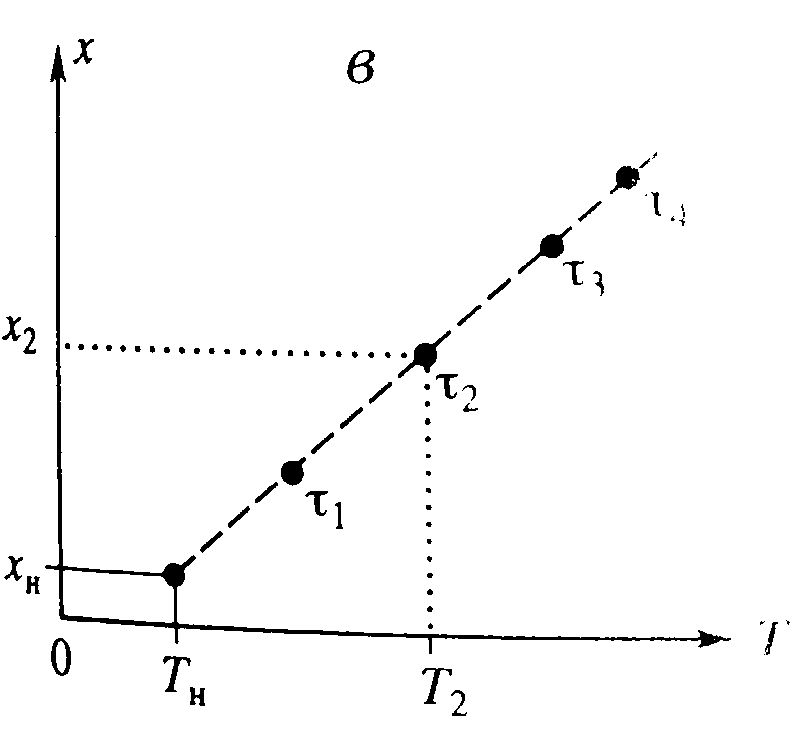
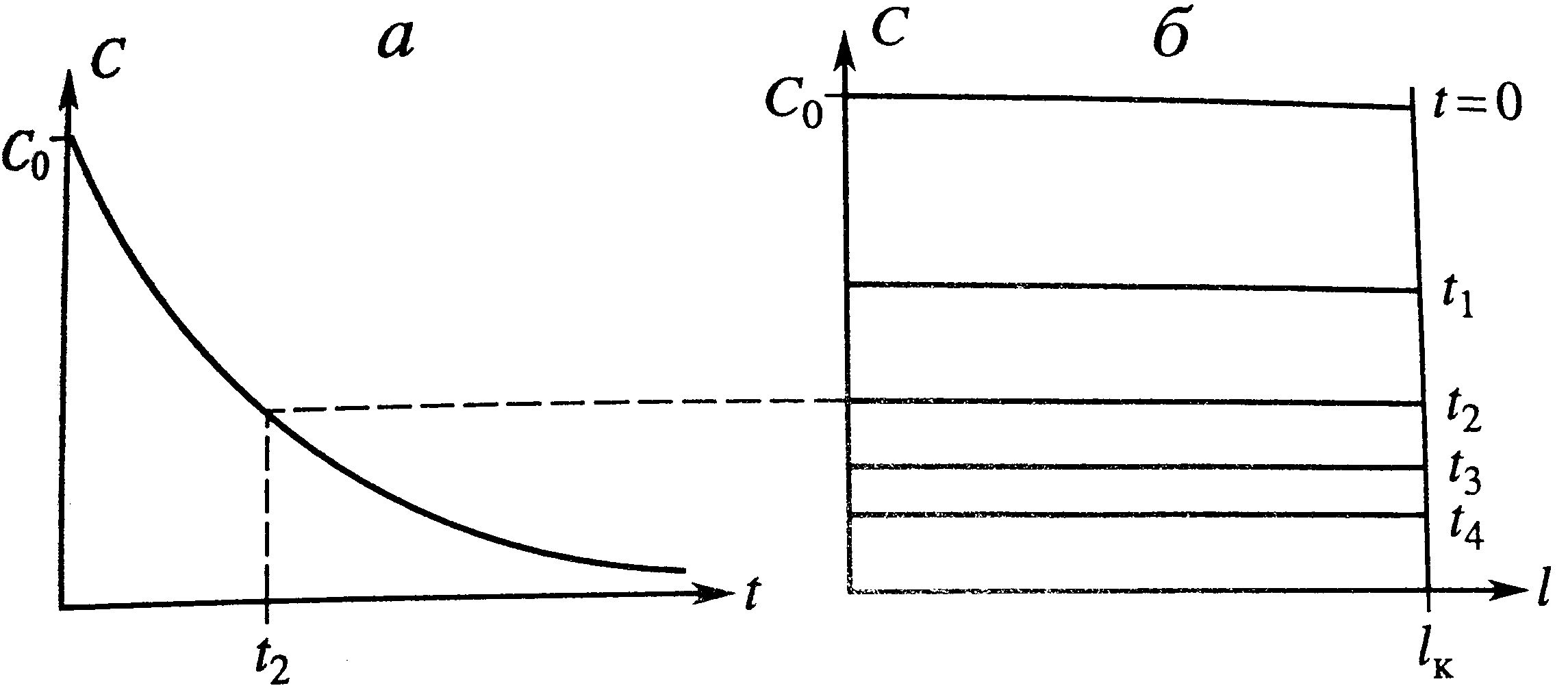 По графику τ→∞, С→0, х→1 – что отвечает тому, что в необратимой реакции исх.в-во постепенно расходуется до его полного превращения.
В режиме ИС-п процесс протекает нестационарно, и со временем t концентрация исх.в-ва С уменьшается. Если взять по длине реактора, то в каждый моментвремени С во всех точках реактора одинакова. По графику τ→∞, С→0, х→1 – что отвечает тому, что в необратимой реакции исх.в-во постепенно расходуется до его полного превращения.
В режиме ИС-п процесс протекает нестационарно, и со временем t концентрация исх.в-ва С уменьшается. Если взять по длине реактора, то в каждый моментвремени С во всех точках реактора одинакова.
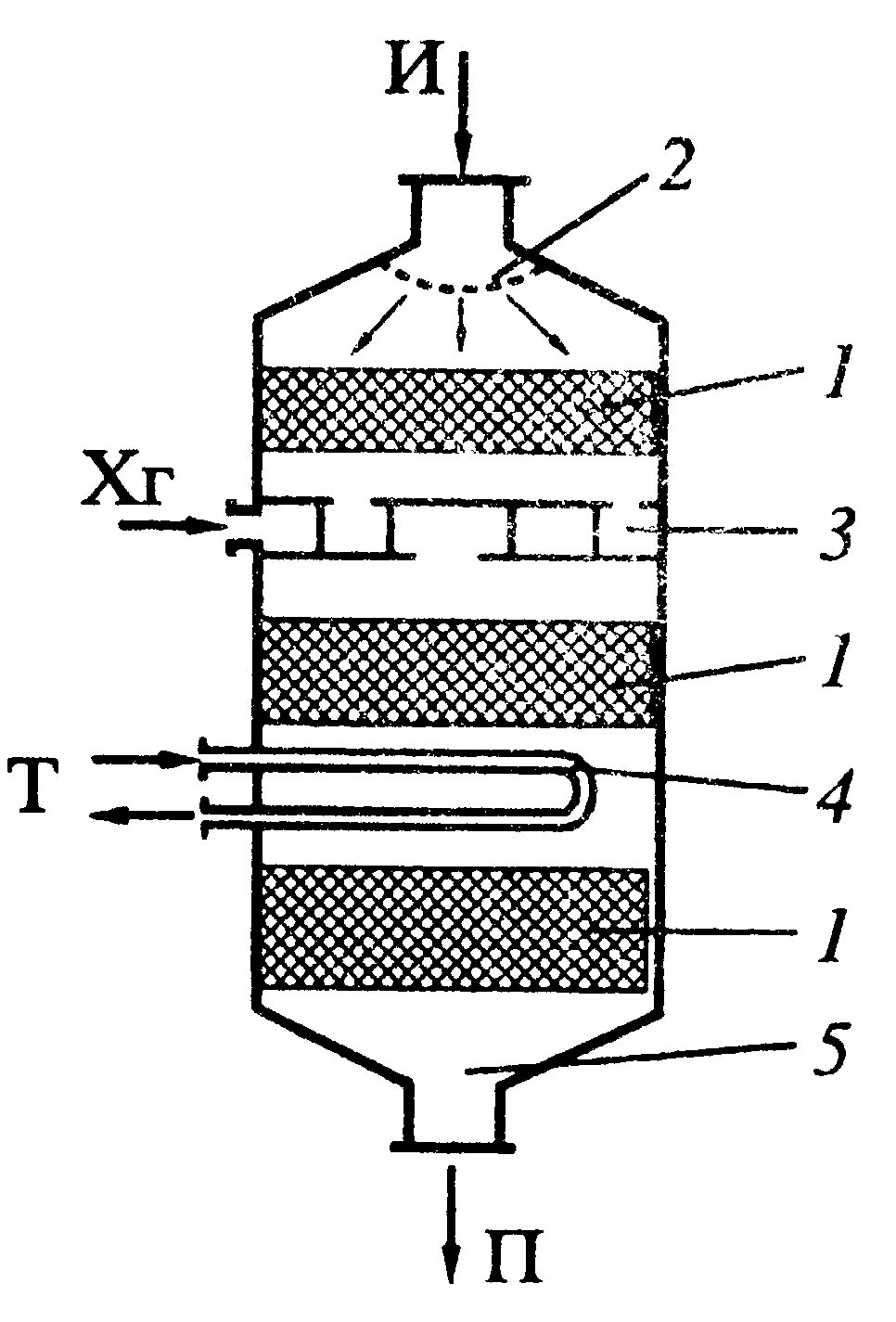
| Схема:
Т- теплоноситель, Хг – холодный газ, И – исходная смесь, П – продукт.
 1-Анализ физических и химических составляющих реакционного процесса.
2- Определение термодинамических и кинетических закономерностей и их взаимодействие.
3-Синтез – построение ММ процесса по результатам анализа, запись описывающего его уравнения.
4-Изучение свойств, используя математический аппарат, проводят вычисления.
5-Интерпретировать – доступная трактовка, объяснения
Основные матем.модели:
1) модель идеального смешения, периодический – ИС-п
dNi/dt=Wi(C;T)Vp; t=Ci0∫(dx/W(x,T); dCi/dt=Wi(C,T) 1-Анализ физических и химических составляющих реакционного процесса.
2- Определение термодинамических и кинетических закономерностей и их взаимодействие.
3-Синтез – построение ММ процесса по результатам анализа, запись описывающего его уравнения.
4-Изучение свойств, используя математический аппарат, проводят вычисления.
5-Интерпретировать – доступная трактовка, объяснения
Основные матем.модели:
1) модель идеального смешения, периодический – ИС-п
dNi/dt=Wi(C;T)Vp; t=Ci0∫(dx/W(x,T); dCi/dt=Wi(C,T)
| Наблюдаемая скорость:
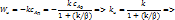
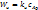 1)
1) 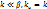 – кинетический режим, – кинетический режим, 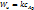 2)
2) 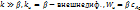 Интенсификация:
1)кинетический: ↑T;
2)внешнедиф.: ↑W =>↑β.
Интенсификация:
1)кинетический: ↑T;
2)внешнедиф.: ↑W =>↑β.
|
Изотермический процесс в РИС-непрерывный.
Процесс описывается уравнением: (С-С0)/τ=W(C).
 Простая необратимая реакция А→В: W(C)=-kC отсюда (С0-С)/τ=kC или через степень превращения х/τ=k(1-x). Из этих уравнений С=С0/(1+kτ) и х=kτ/(1+kτ). Для каждого конкретного проточного реактора Vp/V0=τ. Концентрация вещества во всех точках реактора одинакова и равна C, на входе С0. На входе происходит скачок от С0 до С. Поэтому распределение концентраций – ступенчатая линия, высота ступени (С0-С).
Влияние температуры: От температуры зависит только k – константа скорости k=k0e-E/RT, Т растет и k растет. При протекании простой необратимой реакции с ростом Т уменьшается τ. Для графика Т2>T1. Простая необратимая реакция А→В: W(C)=-kC отсюда (С0-С)/τ=kC или через степень превращения х/τ=k(1-x). Из этих уравнений С=С0/(1+kτ) и х=kτ/(1+kτ). Для каждого конкретного проточного реактора Vp/V0=τ. Концентрация вещества во всех точках реактора одинакова и равна C, на входе С0. На входе происходит скачок от С0 до С. Поэтому распределение концентраций – ступенчатая линия, высота ступени (С0-С).
Влияние температуры: От температуры зависит только k – константа скорости k=k0e-E/RT, Т растет и k растет. При протекании простой необратимой реакции с ростом Т уменьшается τ. Для графика Т2>T1.
 Простая обратимая реакция А↔R: Модель процесса (С-С0)/τ=W(C), через степень превращения х/τ=k1(1-x)-k2x. Предельное значение х при τ→∞: х=k1/(k1+k2)=xp – реакция идет до наступления равновесия. На графике штриховой линией – для необратимой (для сравнения Простая обратимая реакция А↔R: Модель процесса (С-С0)/τ=W(C), через степень превращения х/τ=k1(1-x)-k2x. Предельное значение х при τ→∞: х=k1/(k1+k2)=xp – реакция идет до наступления равновесия. На графике штриховой линией – для необратимой (для сравнения
| Селективность: зависит от соотношения констант скоростей реакций и порядка реакций.
  SR’=1/(1+k2/k1∙CAn2-n1) – дифференциальная селективность, SR=CR/(CR+CS)=k1(k1+k2) – интегральная селективность по продукту R/
для параллельных: SR’=1/(1+k2/k1∙CAn2-n1) – дифференциальная селективность, SR=CR/(CR+CS)=k1(k1+k2) – интегральная селективность по продукту R/
для параллельных:
| Сравнение РИВ и РИС при осуществлении в них простых и сложных реакций.
 Сравниваем РИВ и РИС-н, т.к. качественные характеристики зависимостей С(τ) и х(τ), а также влияние на них параметров совпадают.
По интенсивности режима: График для реакции первого порядка, из графика видно, что для достижения одинаковой степени превращения или одинаковой конечной концентрации в РИВ затрачивается меньше времени, т.е. τРИВ<τРИС, соответственно также будут относиться объемы. Т.е. процесс протекает интенсивнее в РИВ. Сравниваем РИВ и РИС-н, т.к. качественные характеристики зависимостей С(τ) и х(τ), а также влияние на них параметров совпадают.
По интенсивности режима: График для реакции первого порядка, из графика видно, что для достижения одинаковой степени превращения или одинаковой конечной концентрации в РИВ затрачивается меньше времени, т.е. τРИВ<τРИС, соответственно также будут относиться объемы. Т.е. процесс протекает интенсивнее в РИВ.
| Неизотермический процесс в химическом реакторе.
ММ для РИВ: процесс стационарный dq/dt=0, тепловое уравнение 0=V0cpT-V0cp(T+dT)+Qpr(C,T)dνp+KTdFT(Tx-T), где V0cpT- тепловой поток, входящий в объем, V0cp(T+dT) – выходящий, все остальное источник теплоты.
dC/dτ=W(C,T); cp(dT/dτ)=Qpr(С, Т) - KTFуд(T-Tx) при С=С0, Т=Т0 и τ=0.
ММ для РИС-п: Время астрономическое для процесса, при простой реакции описывается уравнением W(C,T)=-r(C,T), через степень превращения х=(С0-С)/С0 систему для РИВ приводим к виду: 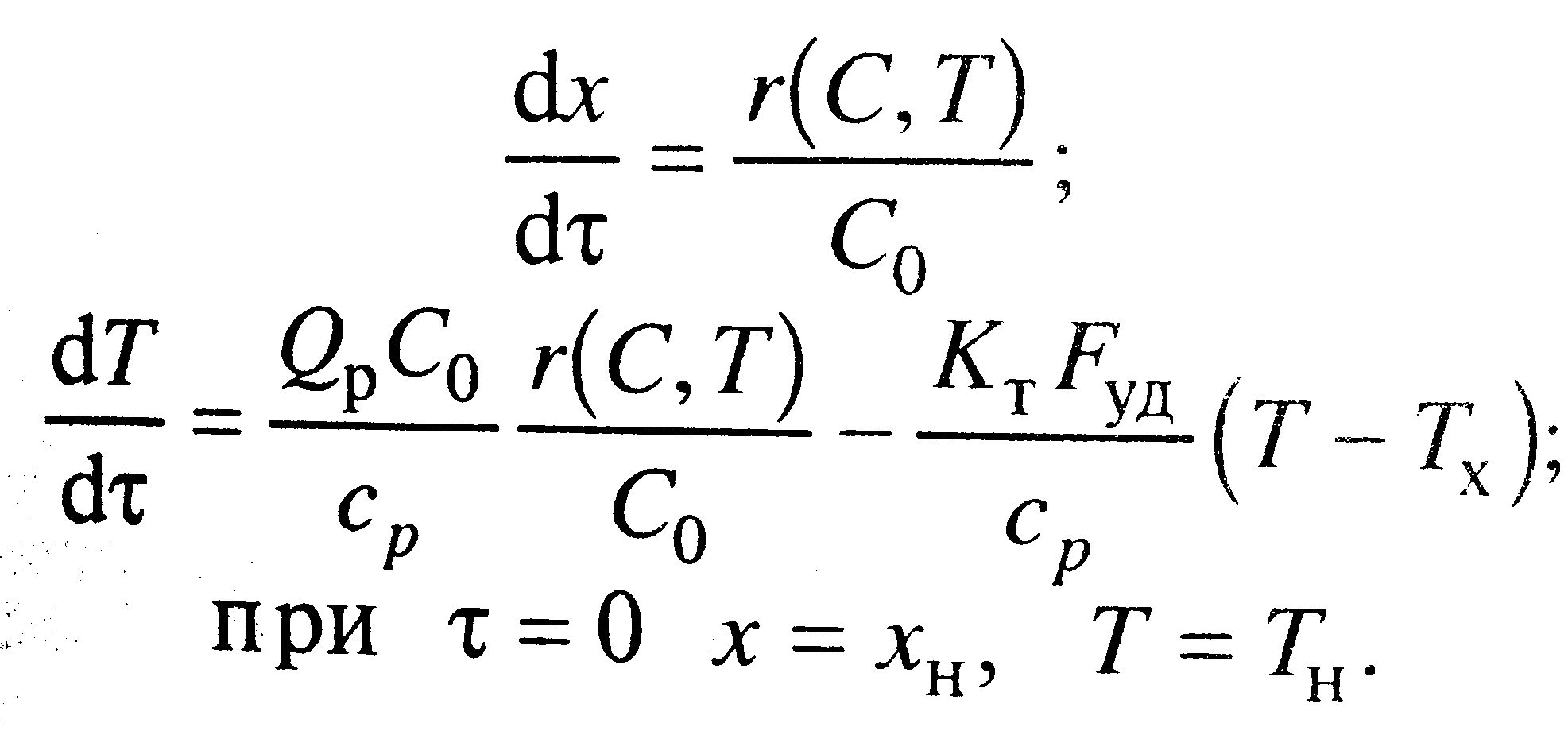 Fуд=F/Vp
Fуд=F/Vp
|
Адиабатический режим РИВ
Для адиабатического разогрева ΔТад=QpC0/cp. В таком режиме теплообмена с окр.средой (теплоносителем) нет. Система имеет вид: 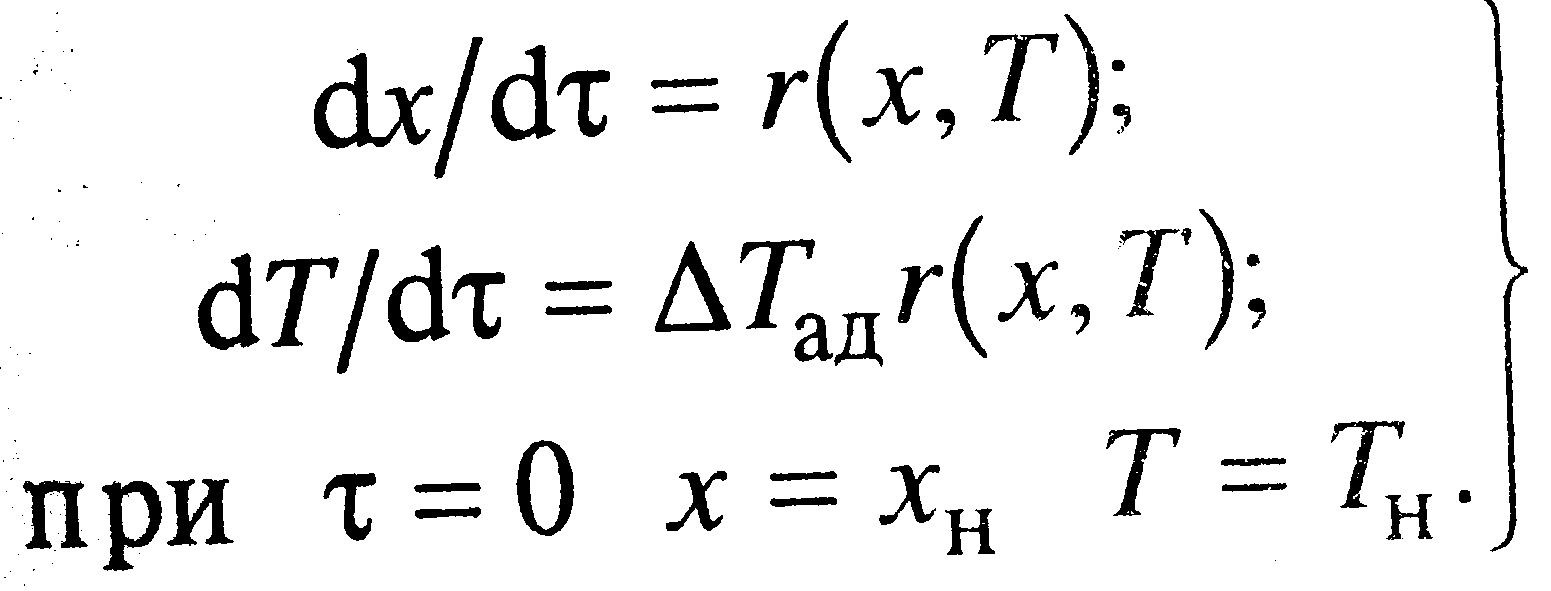 Разделив второе уравнение на первое, получим dT/dx= ΔТад, проинтегрировав его от хн до х и от Тн до Т, находим разогрев смеси: Т-Тн= ΔТад(х-хн).
1-эндотермическа реакция, наклон отрицательный; 2-экзотермическая реакция, наклон положительный;
tgα=1/ ΔТад. Из графиков брать только сплошные линии. Разделив второе уравнение на первое, получим dT/dx= ΔТад, проинтегрировав его от хн до х и от Тн до Т, находим разогрев смеси: Т-Тн= ΔТад(х-хн).
1-эндотермическа реакция, наклон отрицательный; 2-экзотермическая реакция, наклон положительный;
tgα=1/ ΔТад. Из графиков брать только сплошные линии.
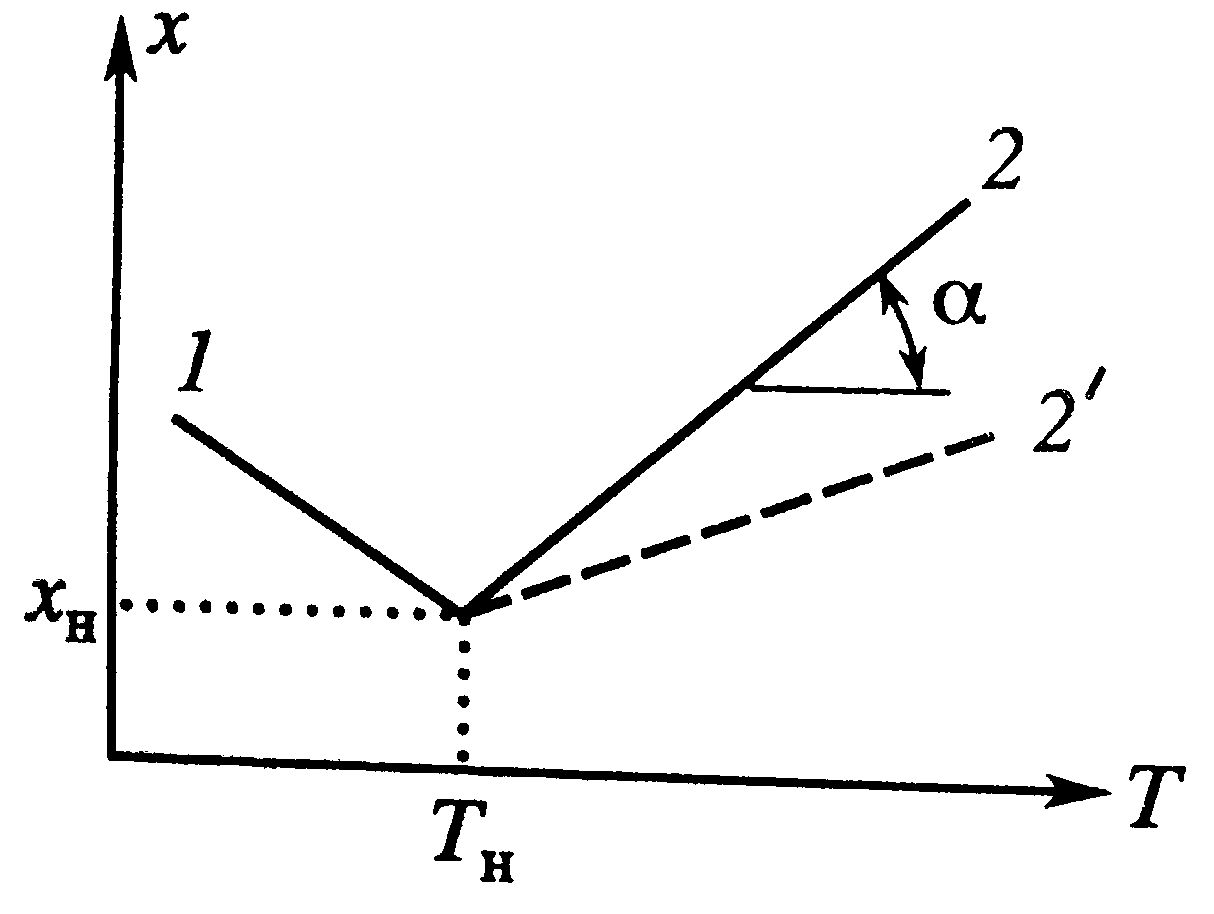 Протекание реакции идет с ростом степени превращения и увеличением (экзо) или уменьшением (эндо) температуры. На зависимость влияет исходная концентрация, увеличение которой приводит к повышению ΔТад, а следовательно и ускорению процесса (кривые 2 на грфикахТ(τ) и х(τ)). Протекание реакции идет с ростом степени превращения и увеличением (экзо) или уменьшением (эндо) температуры. На зависимость влияет исходная концентрация, увеличение которой приводит к повышению ΔТад, а следовательно и ускорению процесса (кривые 2 на грфикахТ(τ) и х(τ)).
| Адиабатический режим в РИС-непрерыв.. Число стационарных режимов. Явление тепловой устойчивости в реакторе. Неоднозначность режимов. Способы управления тепловым режимом. Рассмотреть на примере адиабатического РИС-н.
ММ: (Сi-Ci0)/τ=Wi(C,T); cp(T-T0)/τ=Qpк(С,Т)-KTFуд(Т-Тх)
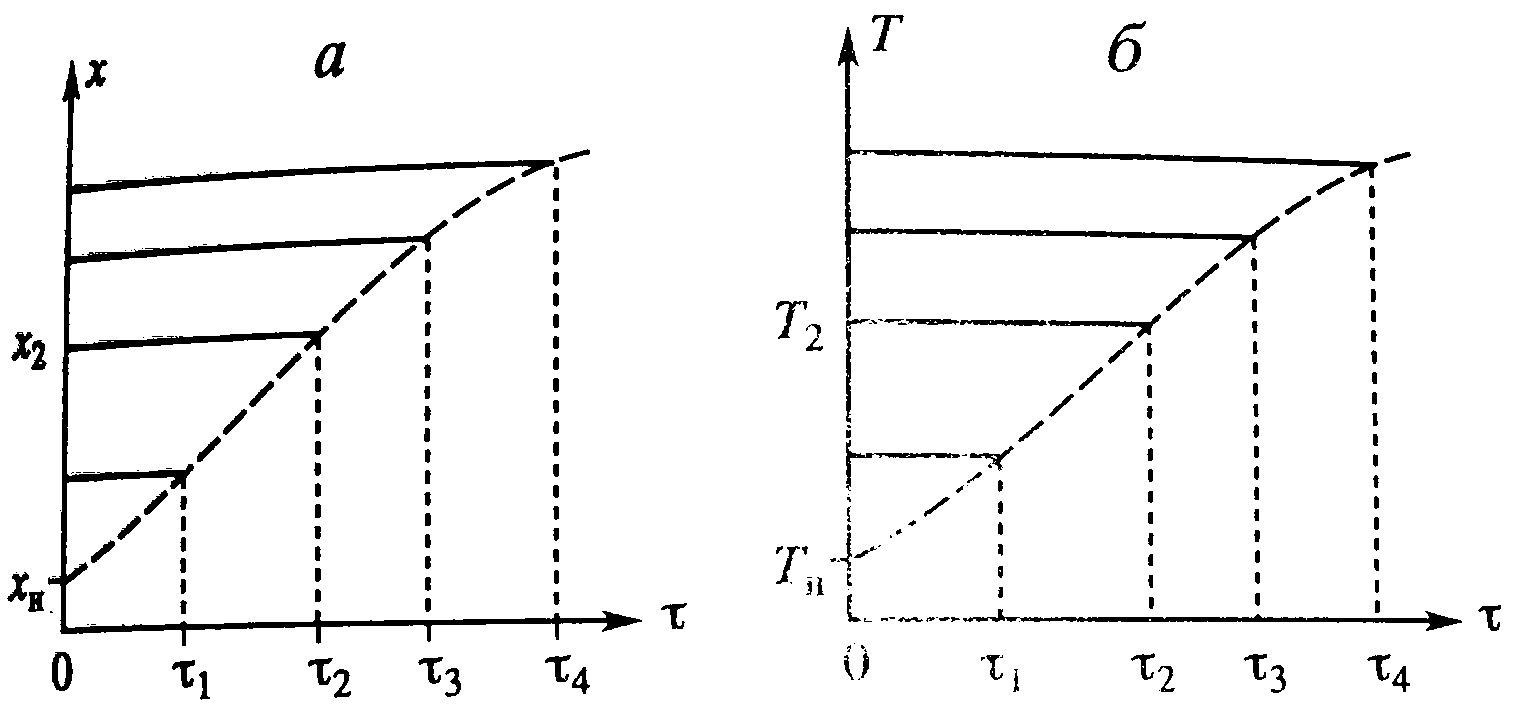 В адиабатическом режиме: (х-хн)/τ=r(x,T) и (Т-Тн)/τ= ΔТад r(x,T). Разделив второе уравнение на первое: Т-Тн= ΔТад(х-хн).
Температура и степень превращения в реакторе будут иметь ступенчатый характер, а также зависимость х(Т) В адиабатическом режиме: (х-хн)/τ=r(x,T) и (Т-Тн)/τ= ΔТад r(x,T). Разделив второе уравнение на первое: Т-Тн= ΔТад(х-хн).
Температура и степень превращения в реакторе будут иметь ступенчатый характер, а также зависимость х(Т)
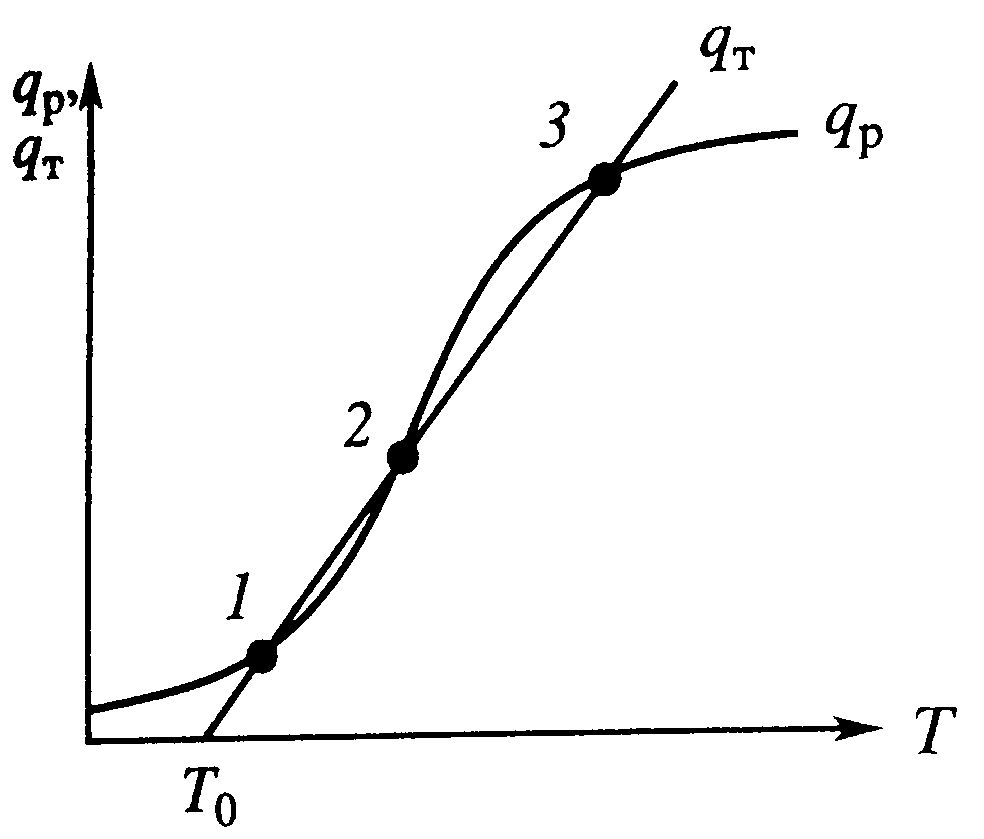
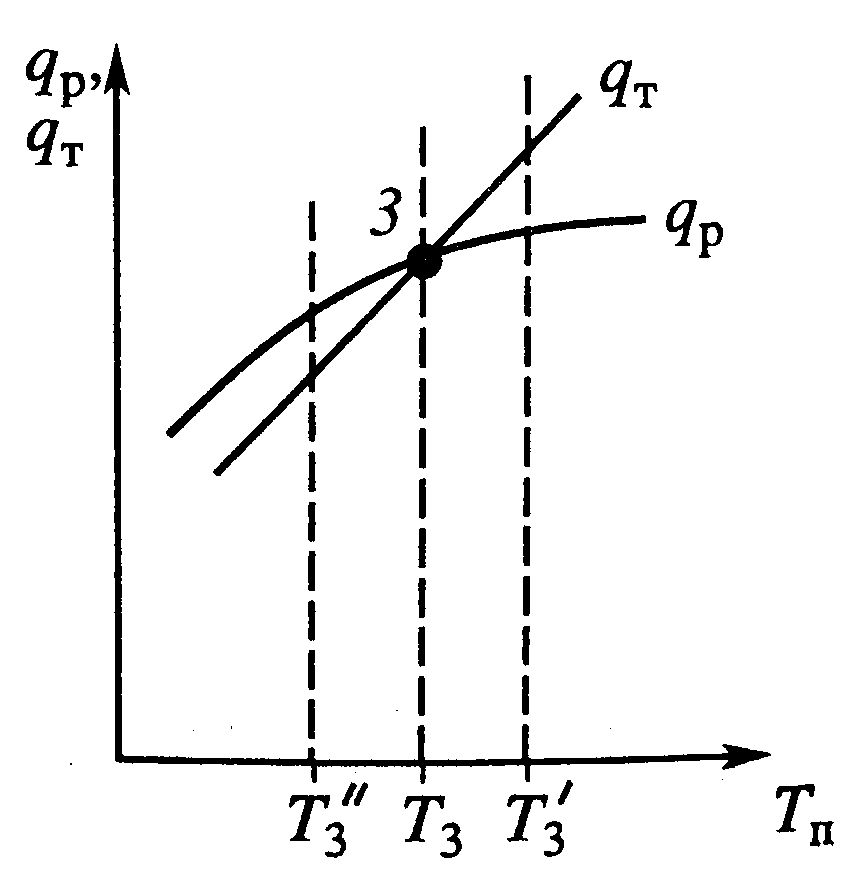
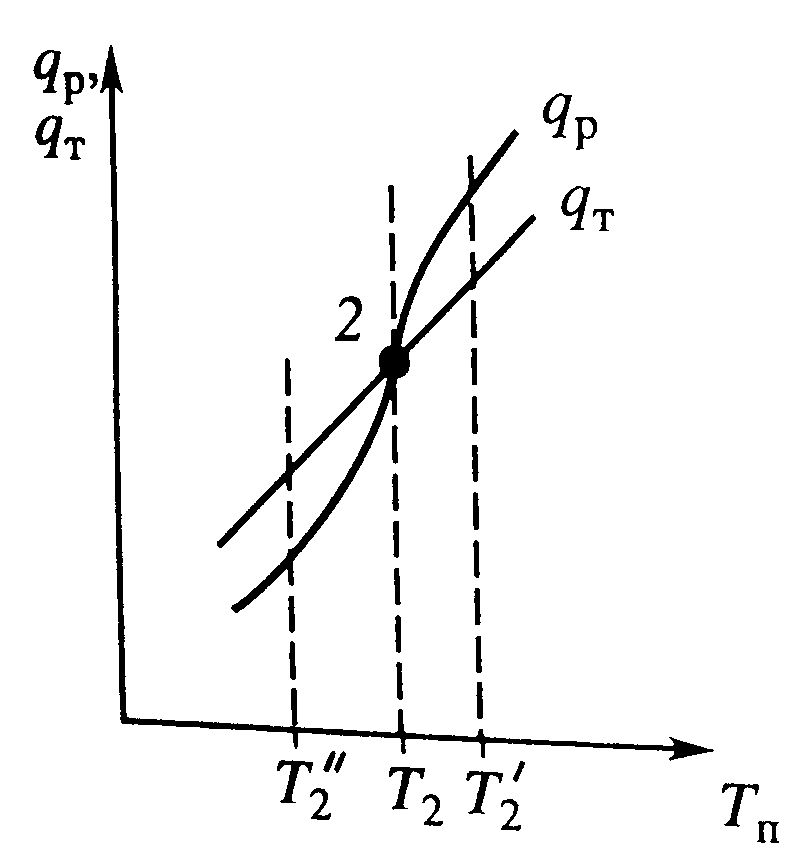
| повышению тепловыделения qp и теплоотвода qТ, причем qТ>qp. Если источник нарушения будет устранен, то превалирующий теплоотвод приедет к нижению температуры и режим вернется в первоначальное состояние. Если ↓T в реакторе, то тепловыделение станет больше теплоотвода и реактор будет разогреваться до  . Аналогичная ситуация и высокотемпературном (3) режиме. Такие стац. состояния, в которых выполняется условие dqp/dTП<dqT/dTp называются устойчивыми.
В среднетемпературном режиме (2) ↑Tвызовет более сильное возрастание тепловыделения, что приведет к увеличению температуры вплоть до установления режима 3. Результатом понижения температуры будет остывание реактора до режима 1. Условие режима dqp/dTП<dqT/dTp – неустойчивый (на практике не применяется).
Устойчивое состояние характеризуется самопроизвольным восстановлением первоначального состояния системы, нарушение которого вызвано внешним нарушением. Неустойчивое - после внесения в него возмущения не восстанавливается.
Неоднозначность режимов – даже если будет убран источник нарушения, режим не восстановиться (например в автотермическом реакторе). . Аналогичная ситуация и высокотемпературном (3) режиме. Такие стац. состояния, в которых выполняется условие dqp/dTП<dqT/dTp называются устойчивыми.
В среднетемпературном режиме (2) ↑Tвызовет более сильное возрастание тепловыделения, что приведет к увеличению температуры вплоть до установления режима 3. Результатом понижения температуры будет остывание реактора до режима 1. Условие режима dqp/dTП<dqT/dTp – неустойчивый (на практике не применяется).
Устойчивое состояние характеризуется самопроизвольным восстановлением первоначального состояния системы, нарушение которого вызвано внешним нарушением. Неустойчивое - после внесения в него возмущения не восстанавливается.
Неоднозначность режимов – даже если будет убран источник нарушения, режим не восстановиться (например в автотермическом реакторе).
| Каскад РИС. Аналитический и графический метод расчета числа реакторов в каскаде.
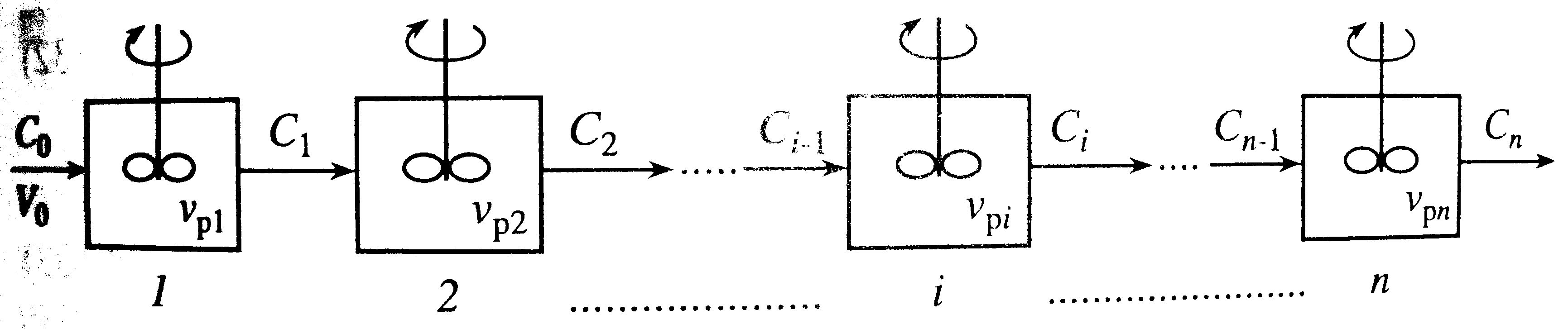 Подбор реакторов, чтобы их суммарный объем был минимальным. Температура во всех реакторах одинаковая, поэтому константы скорости k в них равны. Если порядок реакции больше первого оптимальным будет увеличение объемов реакторов и наоборот.
Аналитический способ: для реакции первого порядка, простой необратимой А→R. CA=CA0/(1+τед∙k)m, τед=τобщ/m, τед=Vед.р/υ0, m – число каскадов.
Графический способ: Строим график. Выбираем произвольно CA и при ней находим WA – на графике точка. Проводим через нее прямую от СА0. 1 – концентрация на выходе из первого каскада, из этой точки проводим параллельную линию к первой прямой. Так продолжаем до СА, где m- число прямых линий – число каскадов (по графику m=3).
Подбор реакторов, чтобы их суммарный объем был минимальным. Температура во всех реакторах одинаковая, поэтому константы скорости k в них равны. Если порядок реакции больше первого оптимальным будет увеличение объемов реакторов и наоборот.
Аналитический способ: для реакции первого порядка, простой необратимой А→R. CA=CA0/(1+τед∙k)m, τед=τобщ/m, τед=Vед.р/υ0, m – число каскадов.
Графический способ: Строим график. Выбираем произвольно CA и при ней находим WA – на графике точка. Проводим через нее прямую от СА0. 1 – концентрация на выходе из первого каскада, из этой точки проводим параллельную линию к первой прямой. Так продолжаем до СА, где m- число прямых линий – число каскадов (по графику m=3).
|
|
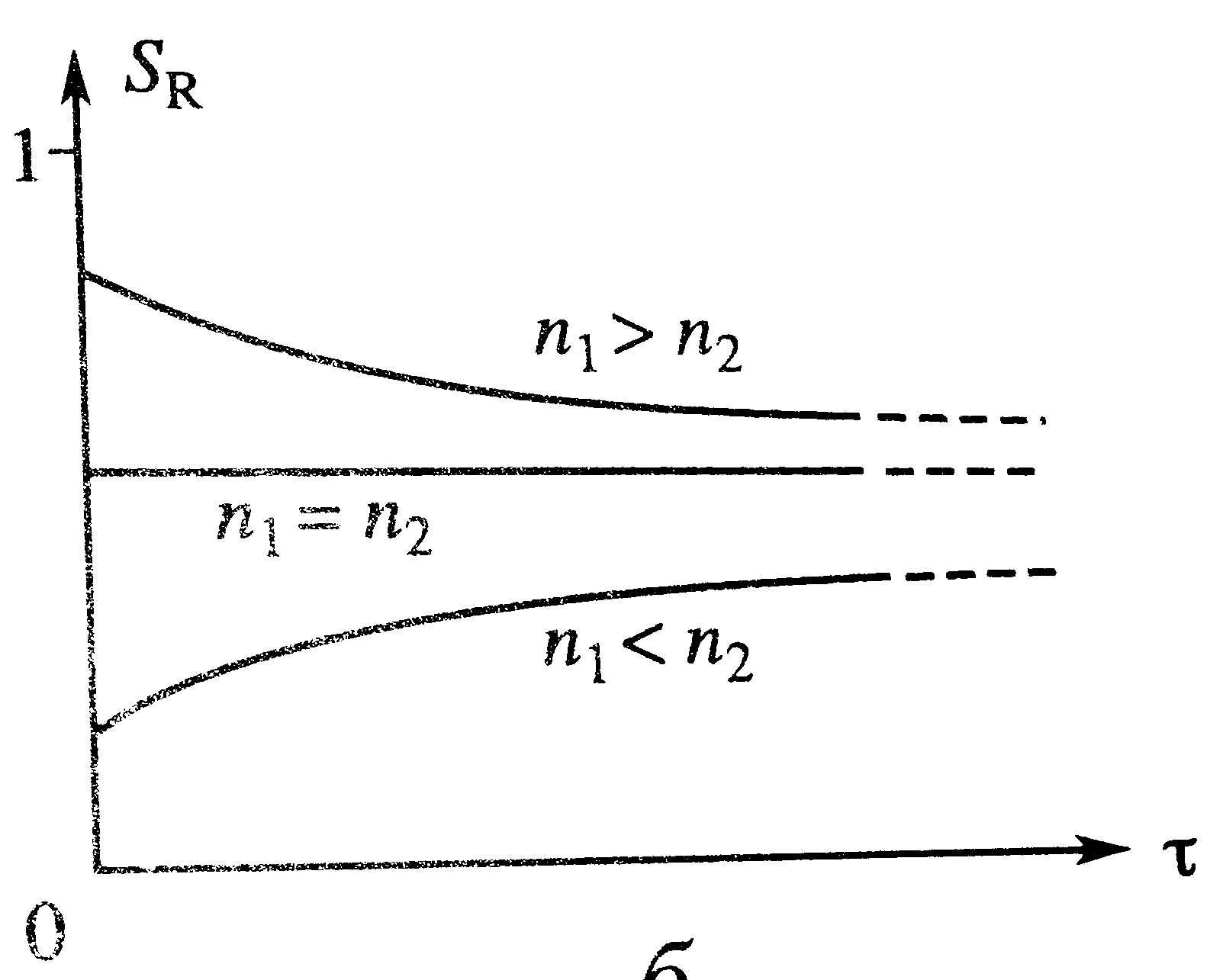
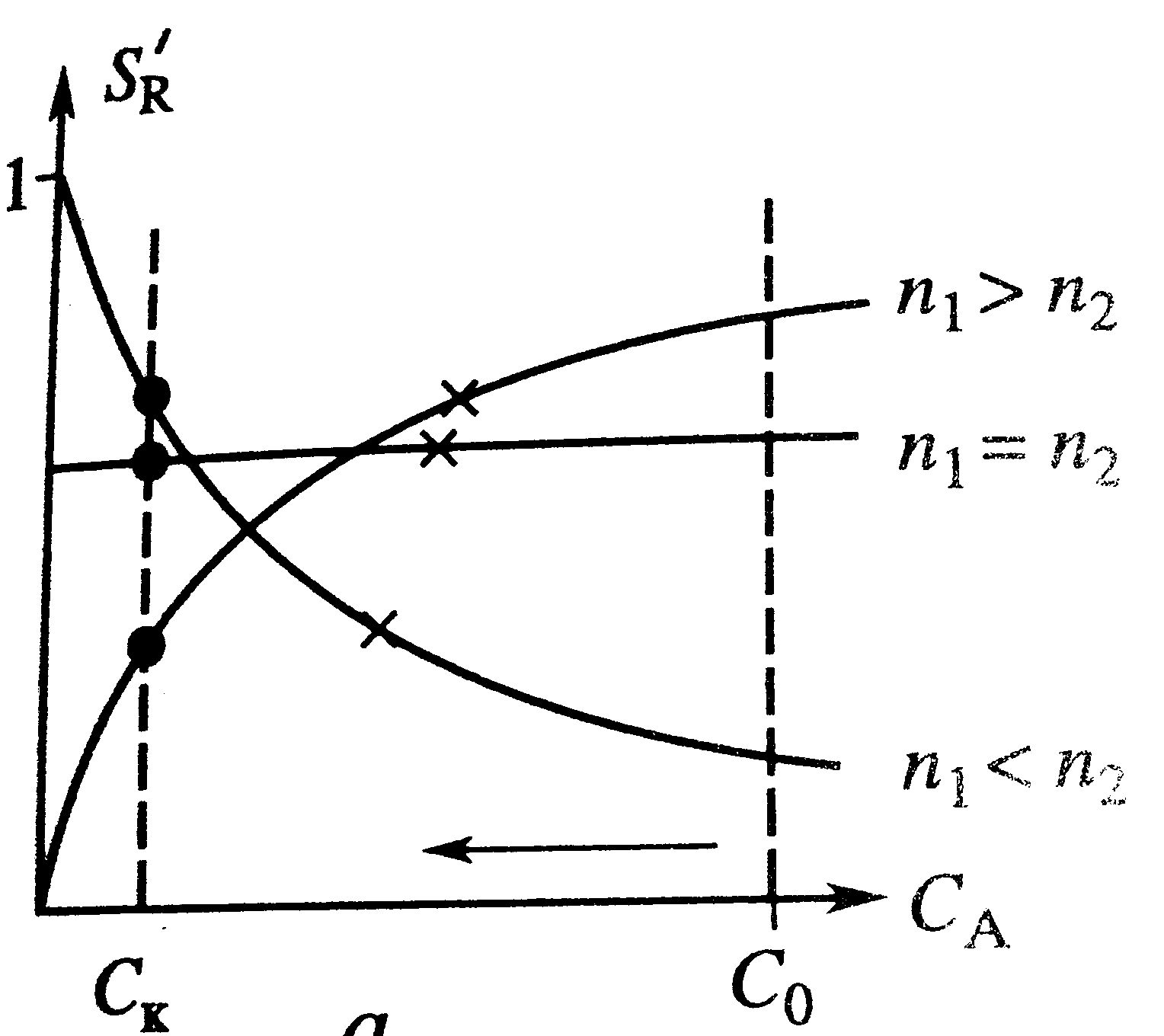
|  По селективности процесса: в РИС весь процесс протекает при конечномзначении концентрации исходного компонента, селективность равна дифференциальной при этой же концентрации S=S'(Cк) – на графике точки. В РИВ концентрация меняется от начальной до конечной и селективность меняется также от начальной до конечной – на графике крестики. График при различных соотношениях порядков реакции в параллельной реакции. При n1>n2 процесс в РИВ интенсивнее и селективнее. При n1<n2 увеличение селективности в РИВ происходит в ущерб его интенсивности. При n1=n2 процесс в РИВ более интенсивен, т.к. селективность не зависит от режима потока в реакторе.
При последовательной реакции селективность по промежуточному продукту всегда уменьшается с глубиной превращения и поэтому SРИС<SРИВ. Режим в РИВ и более интенсивен, и более селективен, а также имеет больший выход промежуточного продукта. По селективности процесса: в РИС весь процесс протекает при конечномзначении концентрации исходного компонента, селективность равна дифференциальной при этой же концентрации S=S'(Cк) – на графике точки. В РИВ концентрация меняется от начальной до конечной и селективность меняется также от начальной до конечной – на графике крестики. График при различных соотношениях порядков реакции в параллельной реакции. При n1>n2 процесс в РИВ интенсивнее и селективнее. При n1<n2 увеличение селективности в РИВ происходит в ущерб его интенсивности. При n1=n2 процесс в РИВ более интенсивен, т.к. селективность не зависит от режима потока в реакторе.
При последовательной реакции селективность по промежуточному продукту всегда уменьшается с глубиной превращения и поэтому SРИС<SРИВ. Режим в РИВ и более интенсивен, и более селективен, а также имеет больший выход промежуточного продукта.
| 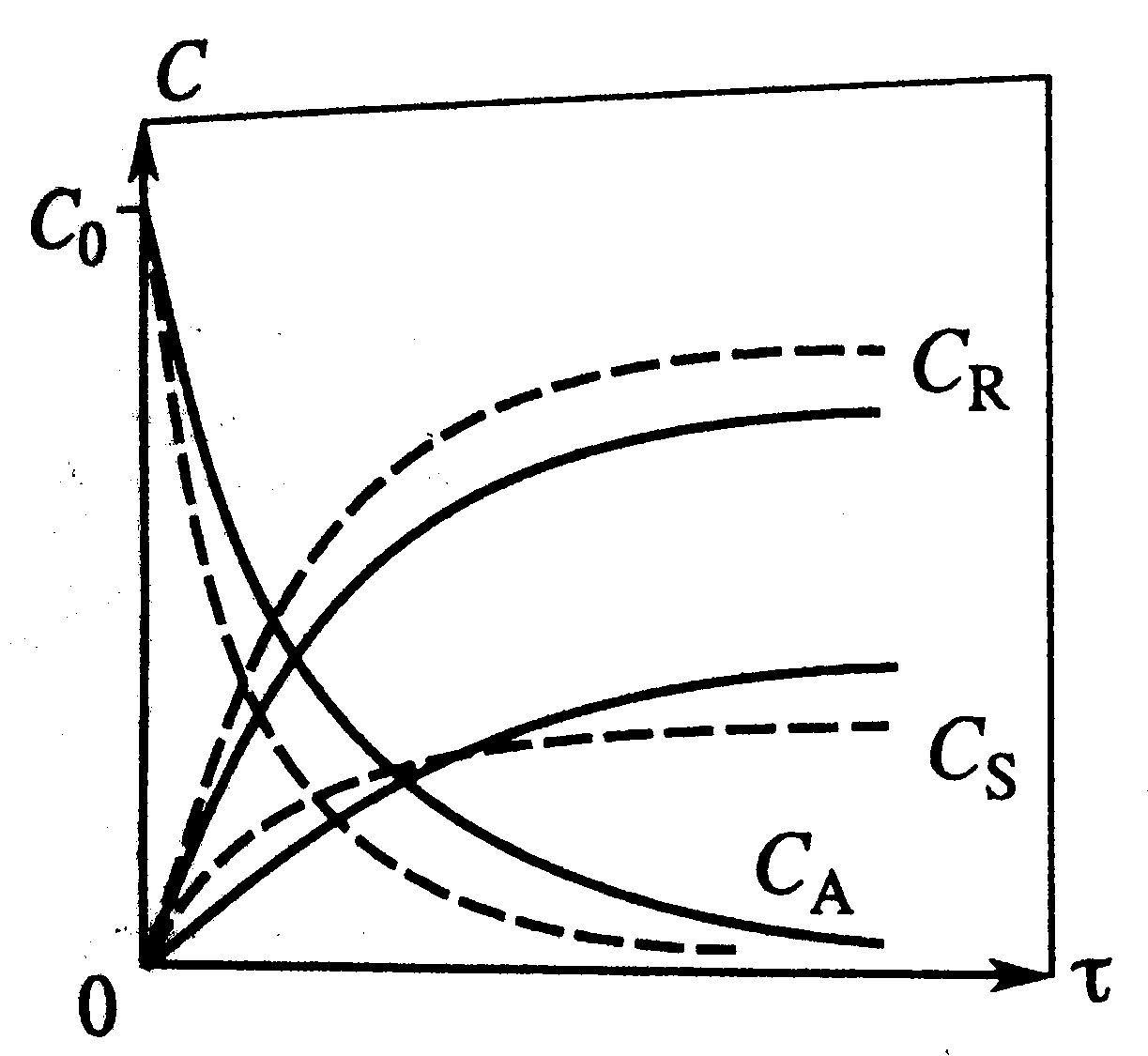 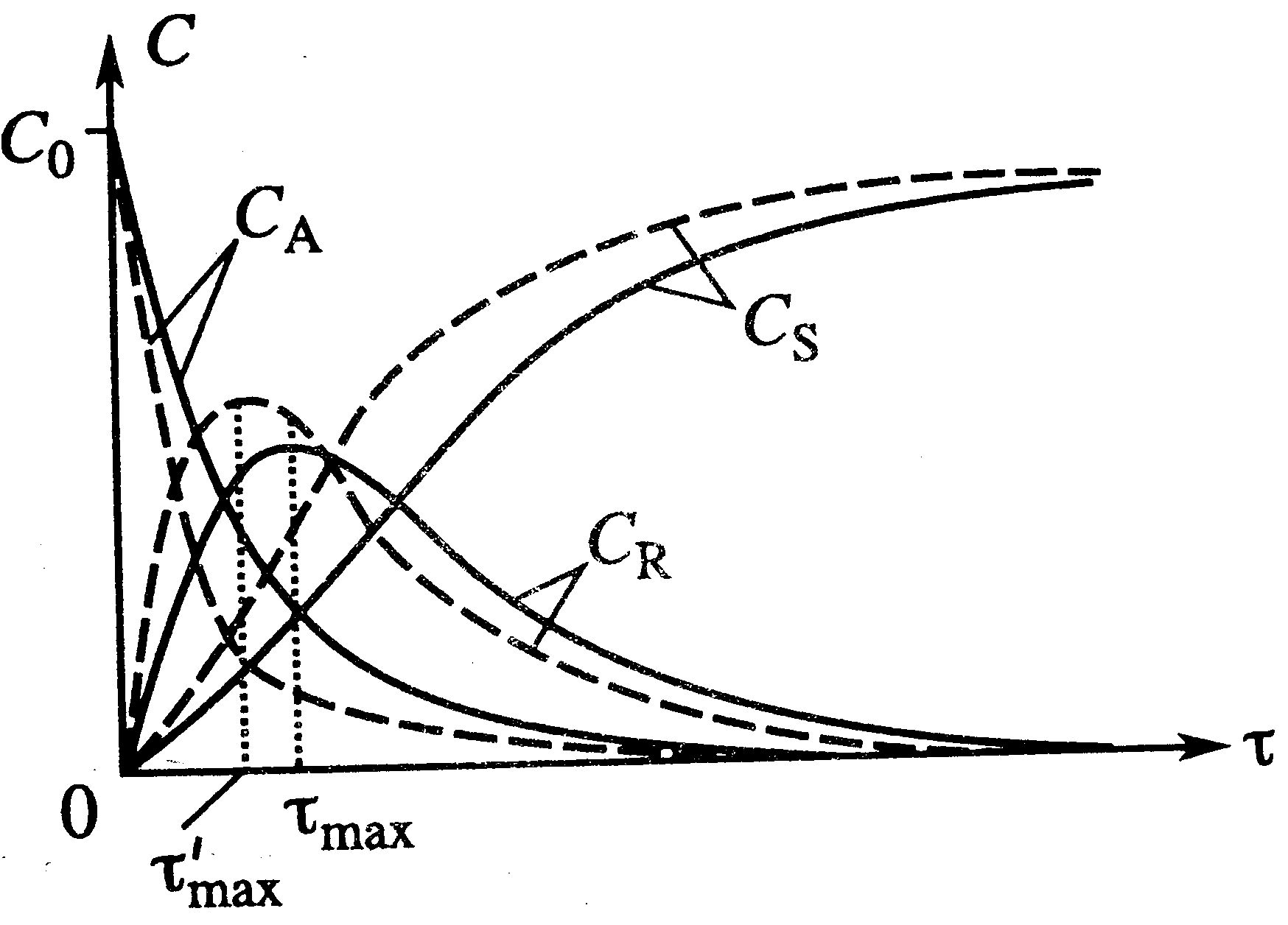 дляпослед: дляпослед:

| Влияние температуры: От температуры зависит только k – константа скорости k=k0e-E/RT, Т растет и k растет.
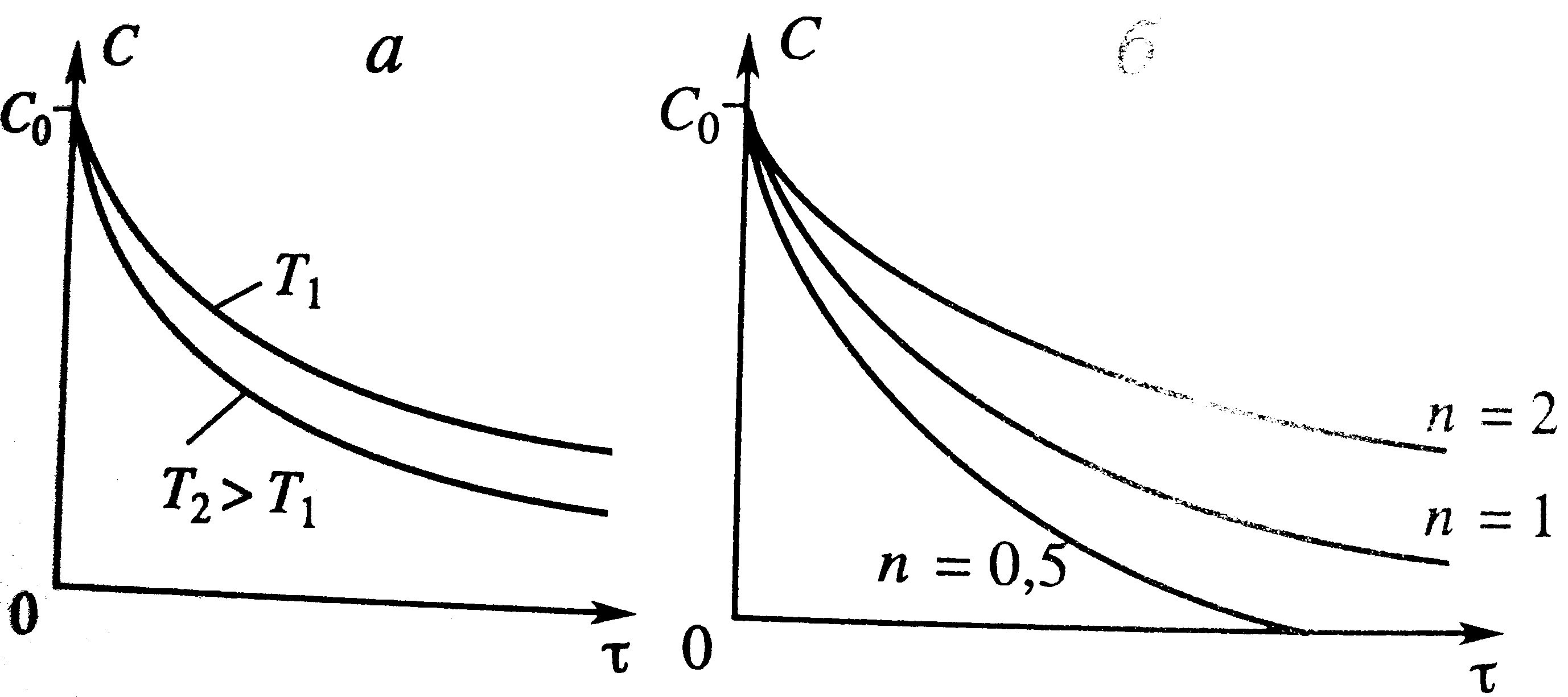 Сложные реакции: Влияние температуры в параллельной: С ростом Т процесс идет интенсивнее, изменение концентрации будет протекать за меньшее время (штриховые линии на графике) при Т2>T1 и Е1>E2. Концентрация S сначала возрастет, а затем уменьшиться, т.к. большая доля А будет расходоваться на образование R.
Влияние температуры в последовательной: С ↑ Т процесс идет интенсивнее, на графике С=f(t) показано штрих линиями при T2>T1. При более↑ Т изменение конц. любого комп. будет происходить за меньшее t. При таких же условиях будет ↑
Сложные реакции: Влияние температуры в параллельной: С ростом Т процесс идет интенсивнее, изменение концентрации будет протекать за меньшее время (штриховые линии на графике) при Т2>T1 и Е1>E2. Концентрация S сначала возрастет, а затем уменьшиться, т.к. большая доля А будет расходоваться на образование R.
Влияние температуры в последовательной: С ↑ Т процесс идет интенсивнее, на графике С=f(t) показано штрих линиями при T2>T1. При более↑ Т изменение конц. любого комп. будет происходить за меньшее t. При таких же условиях будет ↑  процесса по промеж.продукту R. На графике Т1 – сплошная, Т2 – штриховая. ↓ τ ↑ процесса по промеж.продукту R. На графике Т1 – сплошная, Т2 – штриховая. ↓ τ ↑  , уменьшая общее превращение. ↓τ приведет к уменьшению и , уменьшая общее превращение. ↓τ приведет к уменьшению и  и выхода/ и выхода/
|
|
| 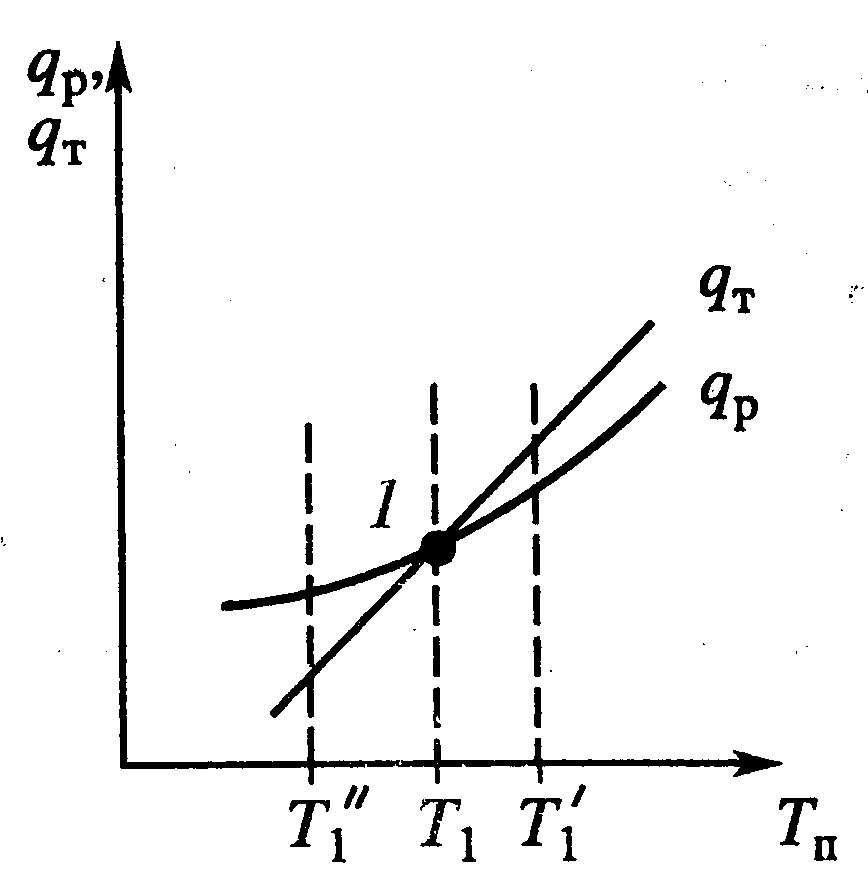   
| – прямая адиабаты Т= Тн+ ΔТад(х-хн).
Число стационарных режимов: Для реакции первого порядка хн=0, тогда х/τ=k(T)(1-x) и (Т-Тн)/τ=ΔТадk(T)(1-x). Из первого уравнения выражаем х и подставляем во второе: 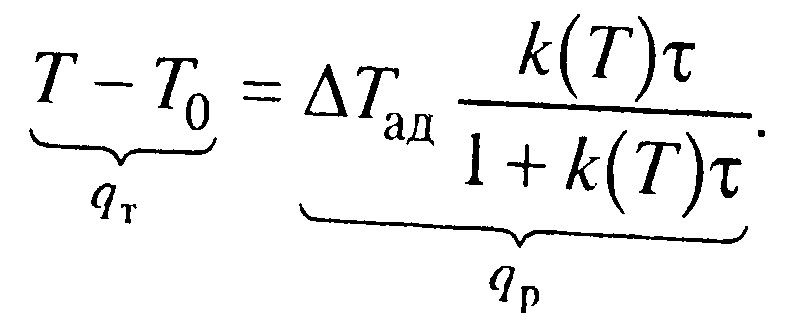 . .
 Решение этого уравнения имеет 1 или 3 корня, а следовательно возможность существования одного или трех стационарных режимов. 1 –низкотемпературный режим, небольшая степень превращения, 3 – при температуре адиабатического разогрева, наиболее полное превращение, 2 – среднетемпературный режим, на практике не применяется; qТ – теплоотвод, qp –тепловыделение.
Тепловая устойчивость:
Если процесс находится в низкотемпературном режиме (1), ему соответствует Т1. Увеличениеэтой температурыприводит к Решение этого уравнения имеет 1 или 3 корня, а следовательно возможность существования одного или трех стационарных режимов. 1 –низкотемпературный режим, небольшая степень превращения, 3 – при температуре адиабатического разогрева, наиболее полное превращение, 2 – среднетемпературный режим, на практике не применяется; qТ – теплоотвод, qp –тепловыделение.
Тепловая устойчивость:
Если процесс находится в низкотемпературном режиме (1), ему соответствует Т1. Увеличениеэтой температурыприводит к
| 
|


 Изотермический процесс РИС-п: Описывается уравнениями dC/dt=W(C), C=C0, при t=0 – астрономическое время. t=τ.
Изотермический процесс РИС-п: Описывается уравнениями dC/dt=W(C), C=C0, при t=0 – астрономическое время. t=τ.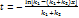

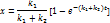
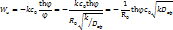 Степень использования внутренней поверхности - отношение
Степень использования внутренней поверхности - отношение  в зерне катализатора к W(
в зерне катализатора к W( ) на поверхности.
) на поверхности.
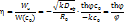


 Безразмерный радиус
Безразмерный радиус 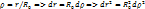 ;
;
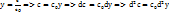 ;
;
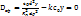 делим на
делим на 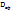 умножаем на
умножаем на 
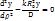
 Катализатор не изменяет равновесие в системе, а направляет процесс по другому пути, с образованием промежуточных продуктов с более низкими энергиями активации. Т.е. не только ускоряет реакцию, но может служить методом управления направленности процессов.
Катализатор не изменяет равновесие в системе, а направляет процесс по другому пути, с образованием промежуточных продуктов с более низкими энергиями активации. Т.е. не только ускоряет реакцию, но может служить методом управления направленности процессов.
 Изотермический процесс РИВ: все также как и в РИС-п, только в режиме ИВ процесс протекает стационарно. Концентрация С меняется по длине реактора.
Изотермический процесс РИВ: все также как и в РИС-п, только в режиме ИВ процесс протекает стационарно. Концентрация С меняется по длине реактора.


 По графику τ→∞, С→0, х→1 – что отвечает тому, что в необратимой реакции исх.в-во постепенно расходуется до его полного превращения.
В режиме ИС-п процесс протекает нестационарно, и со временем t концентрация исх.в-ва С уменьшается. Если взять по длине реактора, то в каждый моментвремени С во всех точках реактора одинакова.
По графику τ→∞, С→0, х→1 – что отвечает тому, что в необратимой реакции исх.в-во постепенно расходуется до его полного превращения.
В режиме ИС-п процесс протекает нестационарно, и со временем t концентрация исх.в-ва С уменьшается. Если взять по длине реактора, то в каждый моментвремени С во всех точках реактора одинакова.
 1-Анализ физических и химических составляющих реакционного процесса.
2- Определение термодинамических и кинетических закономерностей и их взаимодействие.
3-Синтез – построение ММ процесса по результатам анализа, запись описывающего его уравнения.
4-Изучение свойств, используя математический аппарат, проводят вычисления.
5-Интерпретировать – доступная трактовка, объяснения
Основные матем.модели:
1) модель идеального смешения, периодический – ИС-п
dNi/dt=Wi(C;T)Vp; t=Ci0∫(dx/W(x,T); dCi/dt=Wi(C,T)
1-Анализ физических и химических составляющих реакционного процесса.
2- Определение термодинамических и кинетических закономерностей и их взаимодействие.
3-Синтез – построение ММ процесса по результатам анализа, запись описывающего его уравнения.
4-Изучение свойств, используя математический аппарат, проводят вычисления.
5-Интерпретировать – доступная трактовка, объяснения
Основные матем.модели:
1) модель идеального смешения, периодический – ИС-п
dNi/dt=Wi(C;T)Vp; t=Ci0∫(dx/W(x,T); dCi/dt=Wi(C,T)
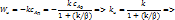
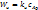 1)
1) 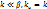 – кинетический режим,
– кинетический режим, 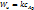 2)
2) 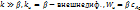 Интенсификация:
1)кинетический: ↑T;
2)внешнедиф.: ↑W =>↑β.
Интенсификация:
1)кинетический: ↑T;
2)внешнедиф.: ↑W =>↑β.
 Простая необратимая реакция А→В: W(C)=-kC отсюда (С0-С)/τ=kC или через степень превращения х/τ=k(1-x). Из этих уравнений С=С0/(1+kτ) и х=kτ/(1+kτ). Для каждого конкретного проточного реактора Vp/V0=τ. Концентрация вещества во всех точках реактора одинакова и равна C, на входе С0. На входе происходит скачок от С0 до С. Поэтому распределение концентраций – ступенчатая линия, высота ступени (С0-С).
Влияние температуры: От температуры зависит только k – константа скорости k=k0e-E/RT, Т растет и k растет. При протекании простой необратимой реакции с ростом Т уменьшается τ. Для графика Т2>T1.
Простая необратимая реакция А→В: W(C)=-kC отсюда (С0-С)/τ=kC или через степень превращения х/τ=k(1-x). Из этих уравнений С=С0/(1+kτ) и х=kτ/(1+kτ). Для каждого конкретного проточного реактора Vp/V0=τ. Концентрация вещества во всех точках реактора одинакова и равна C, на входе С0. На входе происходит скачок от С0 до С. Поэтому распределение концентраций – ступенчатая линия, высота ступени (С0-С).
Влияние температуры: От температуры зависит только k – константа скорости k=k0e-E/RT, Т растет и k растет. При протекании простой необратимой реакции с ростом Т уменьшается τ. Для графика Т2>T1.
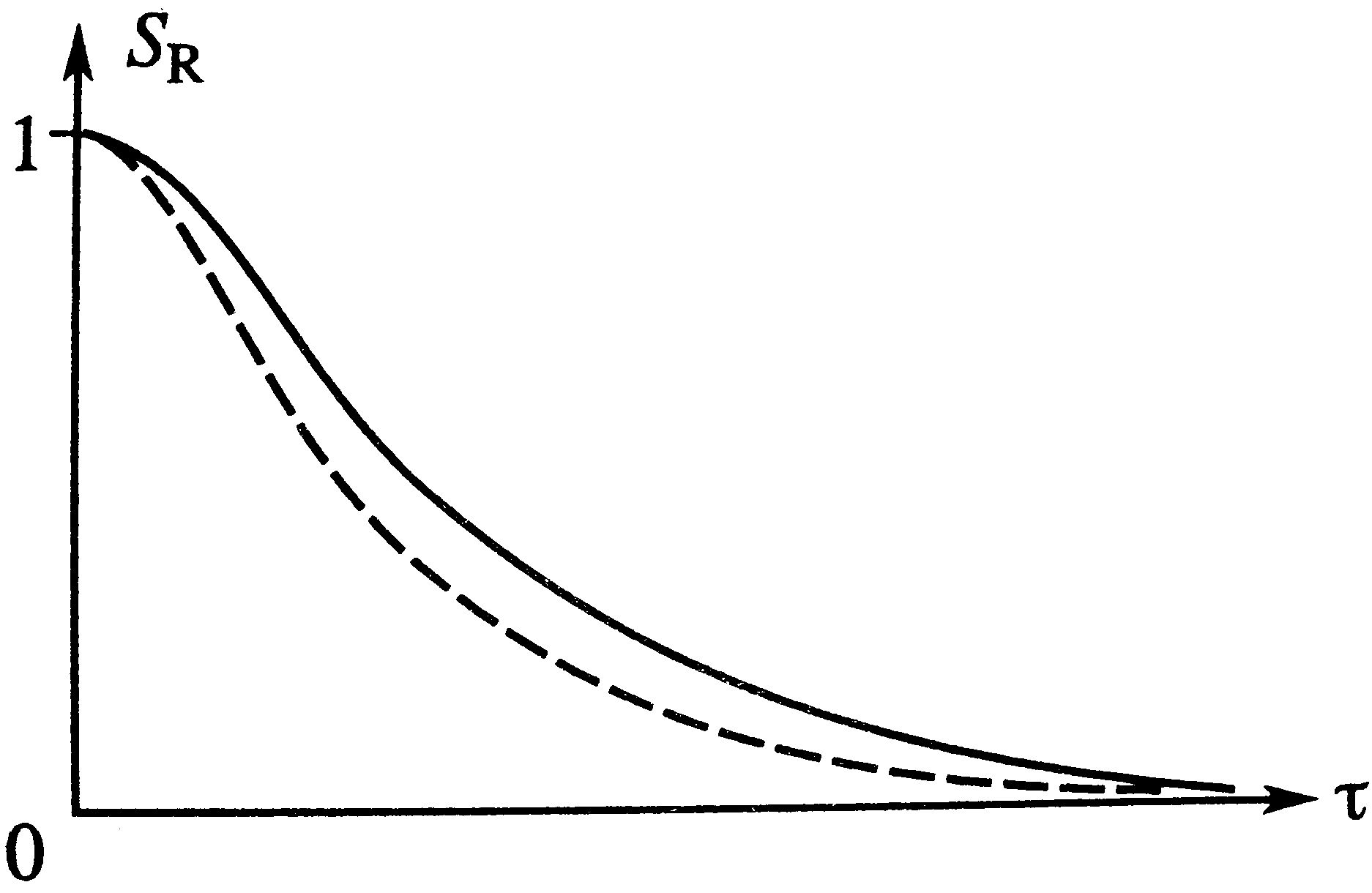
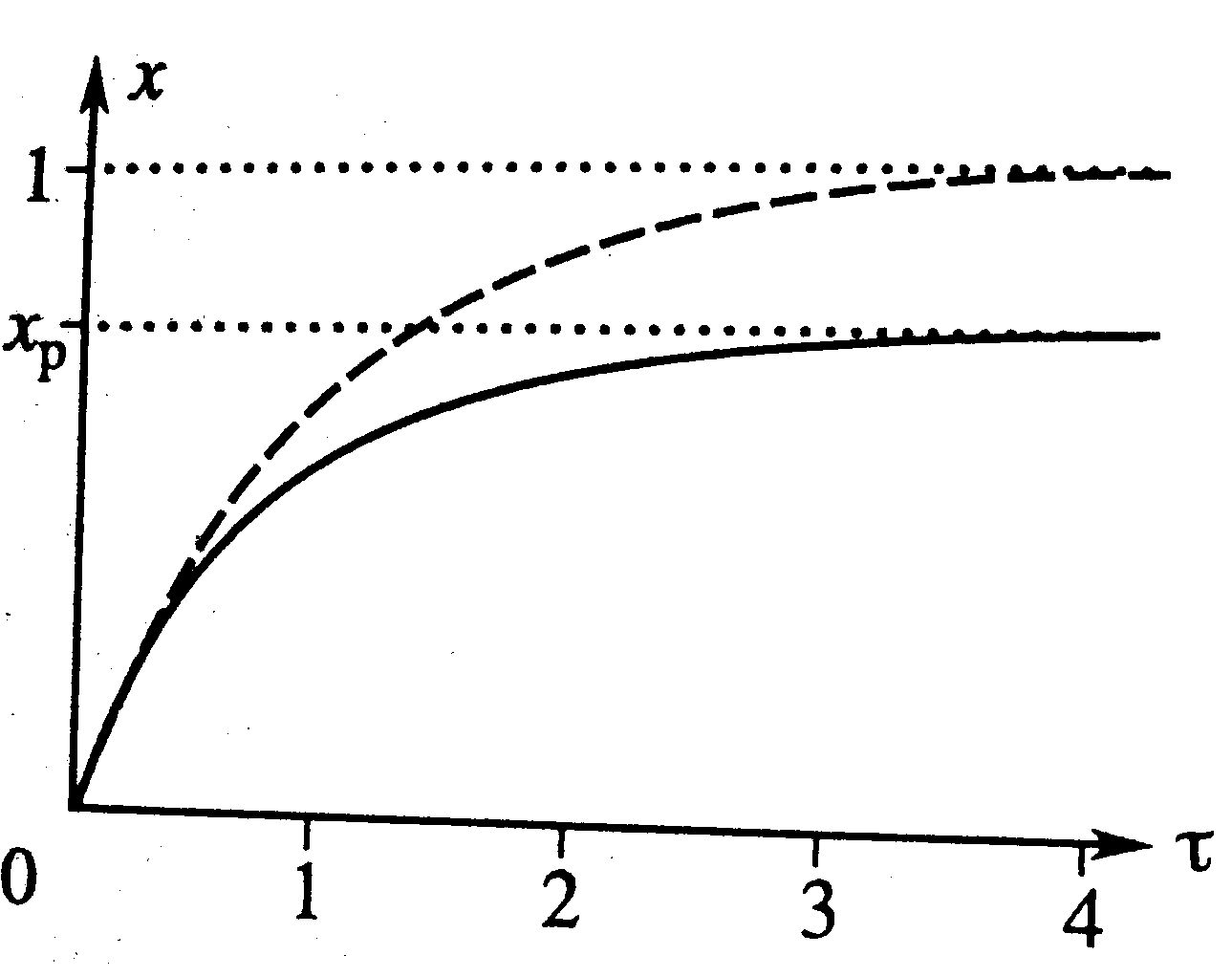
 Простая обратимая реакция А↔R: Модель процесса (С-С0)/τ=W(C), через степень превращения х/τ=k1(1-x)-k2x. Предельное значение х при τ→∞: х=k1/(k1+k2)=xp – реакция идет до наступления равновесия. На графике штриховой линией – для необратимой (для сравнения
Простая обратимая реакция А↔R: Модель процесса (С-С0)/τ=W(C), через степень превращения х/τ=k1(1-x)-k2x. Предельное значение х при τ→∞: х=k1/(k1+k2)=xp – реакция идет до наступления равновесия. На графике штриховой линией – для необратимой (для сравнения

 SR’=1/(1+k2/k1∙CAn2-n1) – дифференциальная селективность, SR=CR/(CR+CS)=k1(k1+k2) – интегральная селективность по продукту R/
для параллельных:
SR’=1/(1+k2/k1∙CAn2-n1) – дифференциальная селективность, SR=CR/(CR+CS)=k1(k1+k2) – интегральная селективность по продукту R/
для параллельных:
 Сравниваем РИВ и РИС-н, т.к. качественные характеристики зависимостей С(τ) и х(τ), а также влияние на них параметров совпадают.
По интенсивности режима: График для реакции первого порядка, из графика видно, что для достижения одинаковой степени превращения или одинаковой конечной концентрации в РИВ затрачивается меньше времени, т.е. τРИВ<τРИС, соответственно также будут относиться объемы. Т.е. процесс протекает интенсивнее в РИВ.
Сравниваем РИВ и РИС-н, т.к. качественные характеристики зависимостей С(τ) и х(τ), а также влияние на них параметров совпадают.
По интенсивности режима: График для реакции первого порядка, из графика видно, что для достижения одинаковой степени превращения или одинаковой конечной концентрации в РИВ затрачивается меньше времени, т.е. τРИВ<τРИС, соответственно также будут относиться объемы. Т.е. процесс протекает интенсивнее в РИВ.
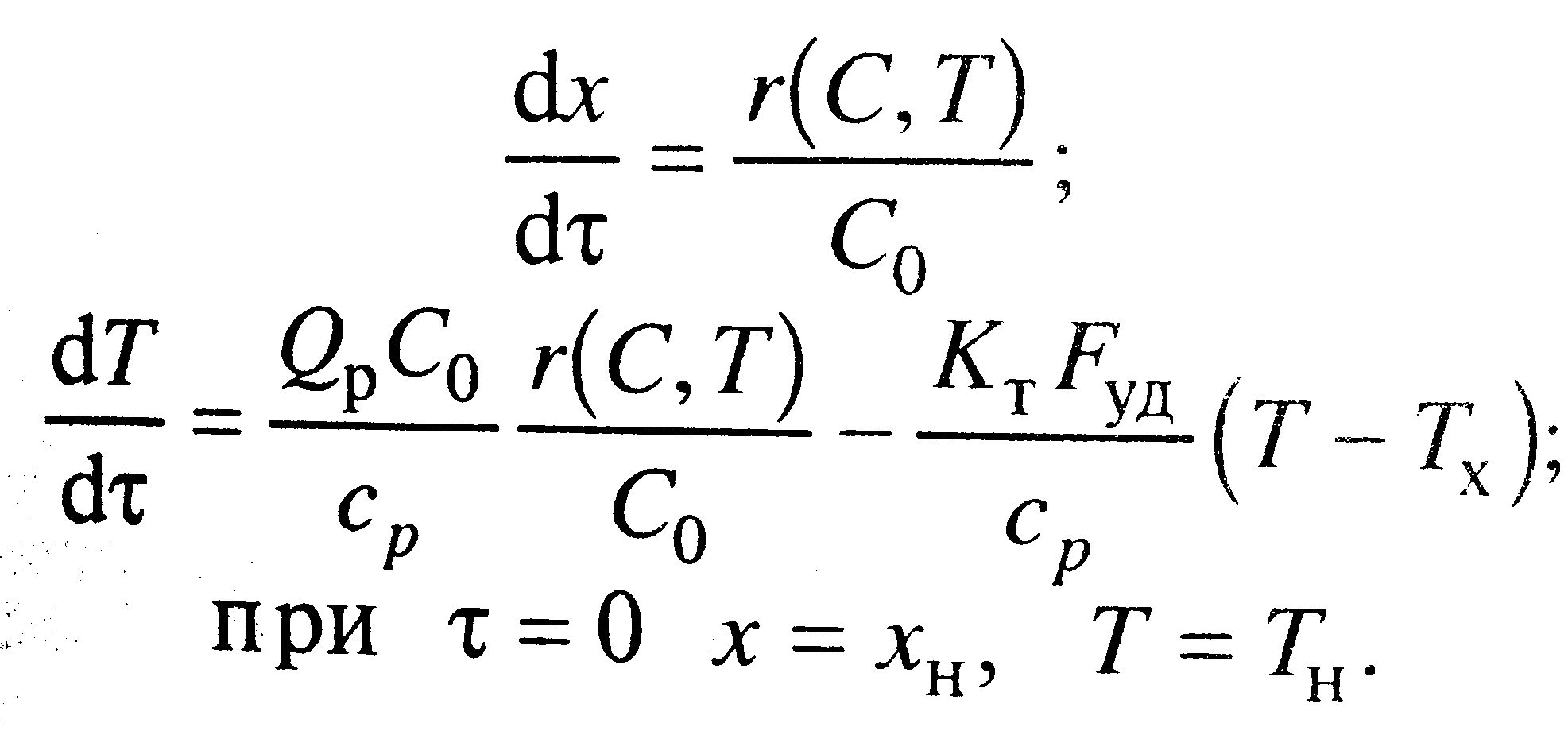 Fуд=F/Vp
Fуд=F/Vp
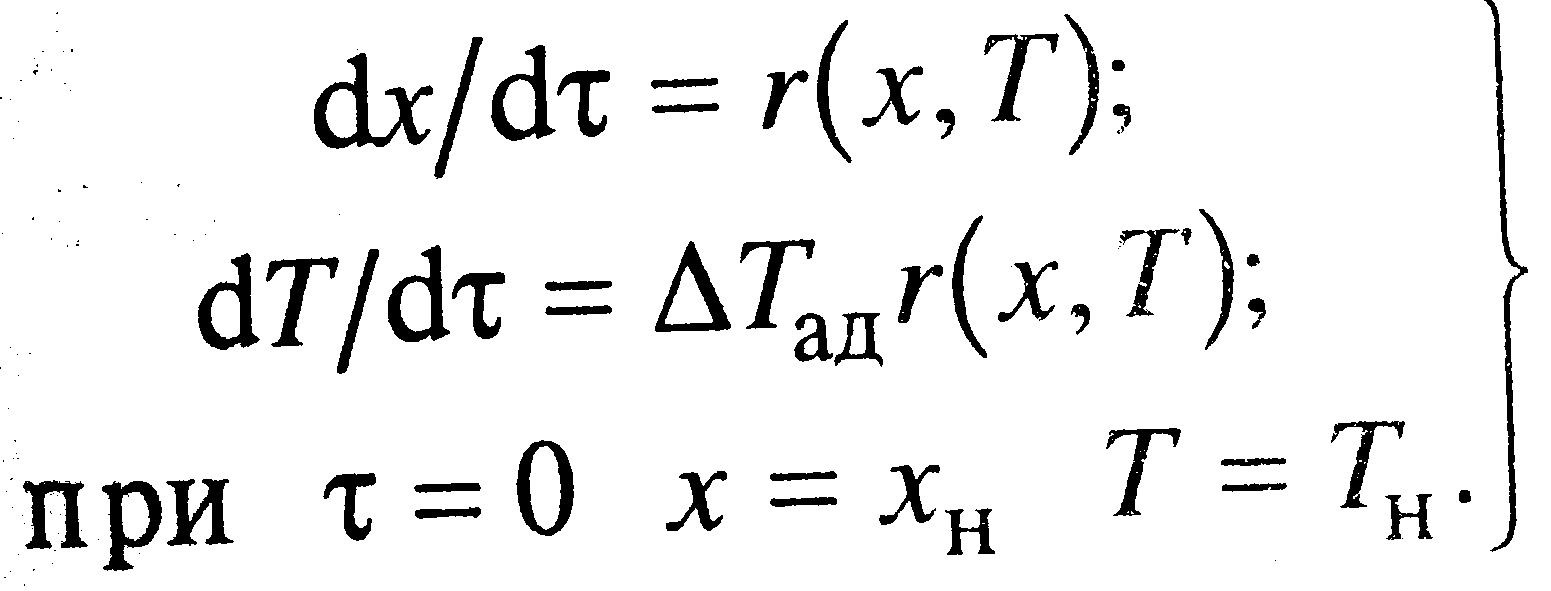 Разделив второе уравнение на первое, получим dT/dx= ΔТад, проинтегрировав его от хн до х и от Тн до Т, находим разогрев смеси: Т-Тн= ΔТад(х-хн).
1-эндотермическа реакция, наклон отрицательный; 2-экзотермическая реакция, наклон положительный;
tgα=1/ ΔТад. Из графиков брать только сплошные линии.
Разделив второе уравнение на первое, получим dT/dx= ΔТад, проинтегрировав его от хн до х и от Тн до Т, находим разогрев смеси: Т-Тн= ΔТад(х-хн).
1-эндотермическа реакция, наклон отрицательный; 2-экзотермическая реакция, наклон положительный;
tgα=1/ ΔТад. Из графиков брать только сплошные линии.
 Протекание реакции идет с ростом степени превращения и увеличением (экзо) или уменьшением (эндо) температуры. На зависимость влияет исходная концентрация, увеличение которой приводит к повышению ΔТад, а следовательно и ускорению процесса (кривые 2 на грфикахТ(τ) и х(τ)).
Протекание реакции идет с ростом степени превращения и увеличением (экзо) или уменьшением (эндо) температуры. На зависимость влияет исходная концентрация, увеличение которой приводит к повышению ΔТад, а следовательно и ускорению процесса (кривые 2 на грфикахТ(τ) и х(τ)).
 В адиабатическом режиме: (х-хн)/τ=r(x,T) и (Т-Тн)/τ= ΔТад r(x,T). Разделив второе уравнение на первое: Т-Тн= ΔТад(х-хн).
Температура и степень превращения в реакторе будут иметь ступенчатый характер, а также зависимость х(Т)
В адиабатическом режиме: (х-хн)/τ=r(x,T) и (Т-Тн)/τ= ΔТад r(x,T). Разделив второе уравнение на первое: Т-Тн= ΔТад(х-хн).
Температура и степень превращения в реакторе будут иметь ступенчатый характер, а также зависимость х(Т)
 . Аналогичная ситуация и высокотемпературном (3) режиме. Такие стац. состояния, в которых выполняется условие dqp/dTП<dqT/dTp называются устойчивыми.
В среднетемпературном режиме (2) ↑Tвызовет более сильное возрастание тепловыделения, что приведет к увеличению температуры вплоть до установления режима 3. Результатом понижения температуры будет остывание реактора до режима 1. Условие режима dqp/dTП<dqT/dTp – неустойчивый (на практике не применяется).
Устойчивое состояние характеризуется самопроизвольным восстановлением первоначального состояния системы, нарушение которого вызвано внешним нарушением. Неустойчивое - после внесения в него возмущения не восстанавливается.
Неоднозначность режимов – даже если будет убран источник нарушения, режим не восстановиться (например в автотермическом реакторе).
. Аналогичная ситуация и высокотемпературном (3) режиме. Такие стац. состояния, в которых выполняется условие dqp/dTП<dqT/dTp называются устойчивыми.
В среднетемпературном режиме (2) ↑Tвызовет более сильное возрастание тепловыделения, что приведет к увеличению температуры вплоть до установления режима 3. Результатом понижения температуры будет остывание реактора до режима 1. Условие режима dqp/dTП<dqT/dTp – неустойчивый (на практике не применяется).
Устойчивое состояние характеризуется самопроизвольным восстановлением первоначального состояния системы, нарушение которого вызвано внешним нарушением. Неустойчивое - после внесения в него возмущения не восстанавливается.
Неоднозначность режимов – даже если будет убран источник нарушения, режим не восстановиться (например в автотермическом реакторе).
 Подбор реакторов, чтобы их суммарный объем был минимальным. Температура во всех реакторах одинаковая, поэтому константы скорости k в них равны. Если порядок реакции больше первого оптимальным будет увеличение объемов реакторов и наоборот.
Аналитический способ: для реакции первого порядка, простой необратимой А→R. CA=CA0/(1+τед∙k)m, τед=τобщ/m, τед=Vед.р/υ0, m – число каскадов.
Графический способ: Строим график. Выбираем произвольно CA и при ней находим WA – на графике точка. Проводим через нее прямую от СА0. 1 – концентрация на выходе из первого каскада, из этой точки проводим параллельную линию к первой прямой. Так продолжаем до СА, где m- число прямых линий – число каскадов (по графику m=3).
Подбор реакторов, чтобы их суммарный объем был минимальным. Температура во всех реакторах одинаковая, поэтому константы скорости k в них равны. Если порядок реакции больше первого оптимальным будет увеличение объемов реакторов и наоборот.
Аналитический способ: для реакции первого порядка, простой необратимой А→R. CA=CA0/(1+τед∙k)m, τед=τобщ/m, τед=Vед.р/υ0, m – число каскадов.
Графический способ: Строим график. Выбираем произвольно CA и при ней находим WA – на графике точка. Проводим через нее прямую от СА0. 1 – концентрация на выходе из первого каскада, из этой точки проводим параллельную линию к первой прямой. Так продолжаем до СА, где m- число прямых линий – число каскадов (по графику m=3).
 По селективности процесса: в РИС весь процесс протекает при конечномзначении концентрации исходного компонента, селективность равна дифференциальной при этой же концентрации S=S'(Cк) – на графике точки. В РИВ концентрация меняется от начальной до конечной и селективность меняется также от начальной до конечной – на графике крестики. График при различных соотношениях порядков реакции в параллельной реакции. При n1>n2 процесс в РИВ интенсивнее и селективнее. При n1<n2 увеличение селективности в РИВ происходит в ущерб его интенсивности. При n1=n2 процесс в РИВ более интенсивен, т.к. селективность не зависит от режима потока в реакторе.
При последовательной реакции селективность по промежуточному продукту всегда уменьшается с глубиной превращения и поэтому SРИС<SРИВ. Режим в РИВ и более интенсивен, и более селективен, а также имеет больший выход промежуточного продукта.
По селективности процесса: в РИС весь процесс протекает при конечномзначении концентрации исходного компонента, селективность равна дифференциальной при этой же концентрации S=S'(Cк) – на графике точки. В РИВ концентрация меняется от начальной до конечной и селективность меняется также от начальной до конечной – на графике крестики. График при различных соотношениях порядков реакции в параллельной реакции. При n1>n2 процесс в РИВ интенсивнее и селективнее. При n1<n2 увеличение селективности в РИВ происходит в ущерб его интенсивности. При n1=n2 процесс в РИВ более интенсивен, т.к. селективность не зависит от режима потока в реакторе.
При последовательной реакции селективность по промежуточному продукту всегда уменьшается с глубиной превращения и поэтому SРИС<SРИВ. Режим в РИВ и более интенсивен, и более селективен, а также имеет больший выход промежуточного продукта.

 дляпослед:
дляпослед:

 Сложные реакции: Влияние температуры в параллельной: С ростом Т процесс идет интенсивнее, изменение концентрации будет протекать за меньшее время (штриховые линии на графике) при Т2>T1 и Е1>E2. Концентрация S сначала возрастет, а затем уменьшиться, т.к. большая доля А будет расходоваться на образование R.
Влияние температуры в последовательной: С ↑ Т процесс идет интенсивнее, на графике С=f(t) показано штрих линиями при T2>T1. При более↑ Т изменение конц. любого комп. будет происходить за меньшее t. При таких же условиях будет ↑
Сложные реакции: Влияние температуры в параллельной: С ростом Т процесс идет интенсивнее, изменение концентрации будет протекать за меньшее время (штриховые линии на графике) при Т2>T1 и Е1>E2. Концентрация S сначала возрастет, а затем уменьшиться, т.к. большая доля А будет расходоваться на образование R.
Влияние температуры в последовательной: С ↑ Т процесс идет интенсивнее, на графике С=f(t) показано штрих линиями при T2>T1. При более↑ Т изменение конц. любого комп. будет происходить за меньшее t. При таких же условиях будет ↑  процесса по промеж.продукту R. На графике Т1 – сплошная, Т2 – штриховая. ↓ τ ↑
процесса по промеж.продукту R. На графике Т1 – сплошная, Т2 – штриховая. ↓ τ ↑  , уменьшая общее превращение. ↓τ приведет к уменьшению и
, уменьшая общее превращение. ↓τ приведет к уменьшению и  и выхода/
и выхода/




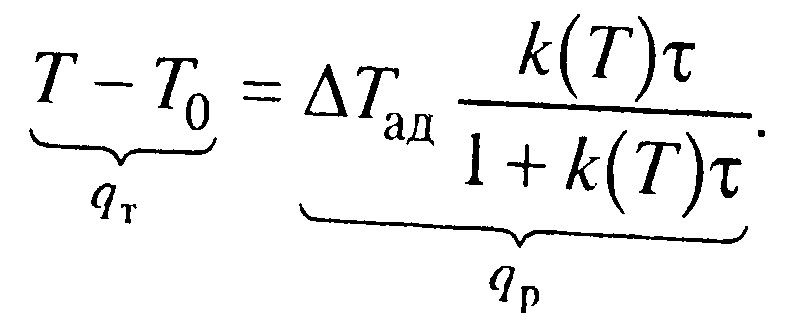 .
.
 Решение этого уравнения имеет 1 или 3 корня, а следовательно возможность существования одного или трех стационарных режимов. 1 –низкотемпературный режим, небольшая степень превращения, 3 – при температуре адиабатического разогрева, наиболее полное превращение, 2 – среднетемпературный режим, на практике не применяется; qТ – теплоотвод, qp –тепловыделение.
Тепловая устойчивость:
Если процесс находится в низкотемпературном режиме (1), ему соответствует Т1. Увеличениеэтой температурыприводит к
Решение этого уравнения имеет 1 или 3 корня, а следовательно возможность существования одного или трех стационарных режимов. 1 –низкотемпературный режим, небольшая степень превращения, 3 – при температуре адиабатического разогрева, наиболее полное превращение, 2 – среднетемпературный режим, на практике не применяется; qТ – теплоотвод, qp –тепловыделение.
Тепловая устойчивость:
Если процесс находится в низкотемпературном режиме (1), ему соответствует Т1. Увеличениеэтой температурыприводит к
