 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Оптимальная температурная последовательность
|
|
R = 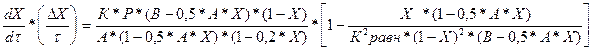
Где:
А = 0,0779
В = 0,1937
Т = 650-900К
Х = 0,8-0,99
Lg Кравн = 
К-константа скорости реакции [1/(атм * сек)]:
1. Если Т<673К, то LgK = 21,9- 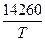

2. Если 673К <= Т => 803K, то LgК = 1,66- 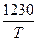
3. Если Т > 803K, то К = 1,36
Для этого определим зависимость скорости реакции от температуры для 6 значений степени превращения (Х), выбранных в интервале от 0,8 до 0,99, установив интервал варьирования температуры 10 град.
Считаем по программе (делала сама) и получаем результат:
Построила зависимость r (T) для выбранных значений степени превращения и определила температуры Т (опт), соответствующие максимумам скорости (r мах) для каждого выбранного значения Х.
| Х | R мах(1/с) | Т опт (К) |
| 0,8 | 0,61587 | |
| 0,83 | 0,49435 | |
| 0,85 | 0,42030 | |
| 0,87 | 0,34950 | |
| 0,89 | 0,28206 | |
| 0,9 | 0,24963 |

На диаграмму Х-Т вместе с равновесной линией Хравн (Т) наношу найденные значения Топт и строю линию оптимальных температур ЛОТ.
Чтобы точнее построить ЛОТ я беру Х = от 0,8 до 0,99 с шагом 0,01 и Т = 650-900К.
Пользуюсь программой лабораторного практикума по ОХТ.
Задаю:
Т = 650-900К
Х = 0,8-0,99
А = 0,0779
В = 0,1937
Р = 1 атм
И получаю значения:
Ограничиваю область протекания процесса окисления в реакторе величиной скорости реакции r = 0.8*r мах для каждого выбранного Х. Наношу их на диаграмму r – Т, определяю температуру, соответствующую r = 0.8*r мах.
1. R = 0.8 * 0.61587 = 0.4927
2. R = 0.8 * 0.49435 = 0.39548
3. R = 0.8 * 0.42030 = 0.33624
4. R = 0.8 * 0.34950 = 0.2796
5. R = 0.8 * 0.28206 = 0.2256
6. R = 0.8 * 0.24963 = 0.1997
Находим значения температур:
| Т1 | Т2 |
На диаграмме Х-Т изображаю температурный режим окисления в каталитическом реакторе. Для этого определим положение адиабаты, соответствующей разогреву в 1-ом слое катализатора, используя формулу:
 Тад =
Тад = 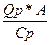
где: Qр – тепловой эффект реакции
А – концентрация SO2 = 0,0779
Cр – теплоемкость смеси
Qр = - 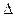 Н
Н
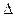 Н = - 101420 + (9,26*Т) = -101420 + (9,26*693) = -95*103 Дж/моль = -95 КДж/моль
Н = - 101420 + (9,26*Т) = -101420 + (9,26*693) = -95*103 Дж/моль = -95 КДж/моль
Qp = 95 КДж/моль * 44,64 моль/м3 = 4240,8 КДж/м3
Ср = АSO 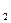 * СрSO
* СрSO 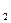 +ВO
+ВO 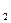 * CpO
* CpO 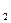 + YN
+ YN 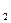 * CpN
* CpN 
Cp берем из справочника при Т = 500 С в КДж/м3*С
Ср = (0,0779 * 2,068) + (0,1937 * 1,403) + (0,7284 * 1,331) = 0,1611 + 0,2718+0,9695 = 1,4024 КДж/м3*С
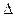 Тад =
Тад = 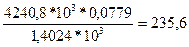
Чтобы построить адиабату использую программу лабораторного практикума с кафедры ОХТ.
Задаю:
Хн = 0
Хк = 0,99
Тн = 693К
Тх.г. = 473К
А = 0,0779
В = 0,1937
Р = 1 атм
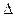 Тад = 235,6
Тад = 235,6
и получаю результат:
Дата публикования: 2015-10-09; Прочитано: 259 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
