 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
основание
|
|
Первичный Вторичный Третичный Четвертичное
Амин амин амин аммониевое
основание
При растворении аминов в воде образуется ион замещённого аммония и ион гидроксила. Например:
H3 C-NH2 +HOH→[H3 C-N+H3 ]OH-
Образующиеся гидроокиси аммониевых оснований вступают в реакцию обмена с анионами электролитов по схеме:
[R-N+H3 ]OH- +KtAn→[R-N+H3 ]An- +KtOH.
В данном случае ионитом удерживается анион электролита, а катион в виде гидроокиси остаётся в растворе.
После использования поглотительной ёмкости катиониты регенерируют.
Для регенерации Na-катионита через него пропускают насыщенный раствор поваренной соли, а для регенерации H-катионита - раствор серной кислоты.
При этом ионы кальция и магния вытесняются ионами натрия. Процесс может быть выражен уравнениями:
(Ca,Mg)R2 +2NaCl↔2NaR+(Ca,Mg)Cl2,
CaR2 +H2 SO4 ↔CaSO4 +2HR.
2.3. Вопросы для повторения
1. Указать, чем обусловлено широкое применение воды в химической промышленности и народном хозяйстве.
2. Назвать способы очистки питьевых и промышленных вод. На чем основано обеззараживающее действие хлора?
3. Чем обусловлена временная, постоянная и общая жёсткость воды? В каких единицах выражается жесткость воды?
4. Назвать основные методы умягчения промышленных вод.
4. Что называется ионообменной ёмкостью катионита и анионита и в каких единицах она выражается?
2.4. Примеры решения типовых задач.
1. К 100 мл исследуемой воды было прибавлено 10 мл 0,0105 н. раствора марганцовокислого калия. После 10 мин кипячения прилито 10 мл 0,01н. раствора щавелевой кислоты, на титрование избытка которой пошло 2 мл раствора перманганата KMnO4. Определить окисляемость воды в пересчёте на кислород.
Решение. Общий объём 0,0105н.раствора перманганата KMnO4 составляет:
10,0+2,0=12,0(мл)
Из них пошло:a)на титрование щавелевой кислоты
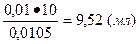 ;
;
б) на окисление органических примесей в 100 мл исследуемой воды
12,0-9,52=2,48 (мл)
Окисляемость исследуемой воды вычисляется по формуле:
 ,
,
где VKMnO4 – расход раствора соли KMnO4 на титрование органических примесей (в мл);
нKMnO4- нормальность раствора перманганата;
экв KMnO4 – эквивалент соли KMnO4.
В нашем примере окисляемость воды будет равна:
0,0105×31,6×2,48×1000 = 8,22 (мг/л),
где 31,6 – эквивалент марганцовокислого калия.
По уравнению (5) находим окисляемость воды (в пересчете на кислород):
316,06 мг перманганата KMnO4 при окислении примесей дают 80 мг О2,
8,22 мг Х мг
Откуда
X =8,22×80/316,06=2,08 (мг/л) О2.
2. В 5 м 3 воды содержится 250 г ионов кальция и 135г ионов магния. Определить общую жесткость воды.
Решение. Найдем содержание ионов кальция и магния (в мг/л) в воде:
250×1000 = 50 (мг/л) ионов Ca2+
5×1000
135×1000 =27 (мг/л) ионов Mg2+ .
5×1000
1мг-экв жесткости отвечает содержанию 20,04 мг/л ионов Ca2+ или 12,16 мг/л ионов Mg2+; следовательно,
Жо=50/20,04 + 27/12,16= 4,715 (мг-экв/л).
Вода умеренно жесткая.
3.Жесткость воды равна 5,4 мг-экв ионов кальция в 1л воды. Какое количество тринатрийфосфата Na3PO4 необходимо взять, чтобы понизить жесткость 1т воды практически до нуля.
Решение. Определим содержание ионов кальция в 1 л воды:
5,4×20,04=108,22 (мг) ионов Ca2+
В тонне воды
108,22×1000=108220 (мг), или 108,22г.
По уравнению реакции
3Ca2++2Na3PO4=Ca3(PO4)2+6Na+,
3×40,08 2×164
где 40,08 и 164 – атомная и молекулярная массы соответственно Ca и Na3PO4.
Количество тринатрийфосфата, необходимое для умягчения 1 т воды, составляет (теоретически):
на 3×40,08 г Ca требуется 2×164 г Na3PO4, а
на 108,22 г x г
Откуда
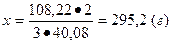 Na3PO4
Na3PO4
4. Определить общую жесткость воды методом комплексометрического титрования, если на 100 мл исследуемой воды пошло 8,5 мл 0,1н. раствора трилона. Поправочный коэффициент трилона равен 1,05. Установлено, что 1мл 0,1н раствора трилона Б соответствует 0,1 мг-экв ионов Ca2+ и Mg2+.
Решение. Общая жесткость воды может быть вычислена по формуле:
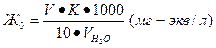 (6)
(6)
где V-количество миллилитров 0,1 н раствора трилона Б, расходуемое на титрование; К-поправочный коэффициент на нормальность; 1000- количество миллилитров в 1 л; 10 (в знаменателе) – коэффициент для перехода к 1н раствору трилона Б; VН2О объем вод (в миллилитрах), взятый для анализа.
Подставляя в формулу (6) данные задачи, получим:
Жо =8,5×1,05×1000/(10×100)=8,925 (мг-экв/л).
Вода жесткая.
5. Определить: 1) карбонатную жесткость воды, если на 100мл исследуемой воды пошло 4,6 мл 0,1н раствора соляной кислоты. Поправочный коэффициент на нормальность кислоты равен 1,1; 2) постоянную жесткость воды, если общая жесткость воды равна 12 мг-экв/л.
Решение. Временная, или карбонатная, жесткость воды, исходя из условий задачи, может быть вычислена по формуле:
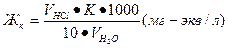 , (6а)
, (6а)
где значения величин аналогичны значениям в примере 4, следовательно,
Жк =4,6×1,1×1000/(10×1000)=5,06 (мг-экв/л).
Постоянная, или некарбонатная, жесткость воды определяется как разность между общей и карбонатной жесткостью:
Жн =Жо -Жк, Жн =12-5,06=6,94 (мг-экв/л).
6.Карбонатная жесткость воды равна 5 мг-экв/л. Определить содержание бикарбоната кальция в 10 м3 воды.
Решение. Содержание ионов Ca2+ в 10м3 воды заданной жесткости будет равно:
5×20,04×10×1000/1000=1002 (г), или 1,002 (кг).
Содержание бикарбоната кальция в 10 м3 воды содержащей 1,002 кг ионов Ca2+:
40,08 кг Ca содержится в 162,1 кг Сa(HCO3)2, а
1,002 кг x кг
где 162,1- молекулярная масса Ca(HCO3)2.
Отсюда
X=162,1×1,002/40,08=4,05 (кг).
7. Определить время работы катионитовой колонки до регенерации, если объем катионита (сульфоуголь) составляет 1,5 м3 и емкость поглощения его равна 1000 г-экв/м; объемная скорость потока воды – 15 м3/ч. Жесткость воды - 8 мг-экв/л, и обусловлена она катионами кальция.
Решение Определим количество грамм-эквивалентов Ca2+, поступающее в колонку в течение 1ч с учетом жесткости воды, равной 8 мг-экв/л (или 8 г-экв/м3) Ca2+.
8×15=120 (г-экв/ч) ионов кальция.
Определим емкость поглощения катионитового фильтра (1,5 м3), если Еп=1000 г-экв/м3
1000×1,5=1500 (г-экв).
Время работы колонки (t) до регенерации с учетом емкости поглощения, скорости потока и жесткости воды будет равно:
1500/120=12,5 (ч).
8. Определить потребность катионита (алюмосиликата) в м3 для умягчения 500 т воды, жесткость которой равна 7,5 мг-экв/л. Емкость поглощения катионита-850 г-экв/м3; плотность воды-1000 кг/м3 .
Р ешение. Жесткость воды, выраженная в г-экв/м3 , составляет:
7,5×1000/1000=7,5(г-экв/м3).
Число грамм-эквивалентов жесткости в 500 т воды составляет:
7,5 г-экв/м3 ×500 м3 =3750 г-экв.
Потребность катионита в м3 с учетом емкости поглощения равна:
3750 г-экв/850г-экв/м3 =4,4 м3
9.Через катионитовый фильтр, рабочий объем которого равен 3,0 м3 , пропускают воду, жесткость ее равна 6,5 мг-экв/л. Объемная скорость течения воды – 10м3/ч. Определить емкость поглощения катионита (Еп) в (г-экв/м3), если фильтр работает без регенерации 2,5 сут.
Решение: В течение 2,5 суток (60 часов) через фильтр проходит воды:
10×60=600 (м3).
Найдем число грамм-эквивалентов ионов кальция и магния, содержащихся в 600 м3 воды. Жесткость 6,5 мг-экв/л соответствует 6.5 г-экв/ м3. Отсюда
6.5 г-экв/ м3×600 м3=3900г-экв.
Емкость поглощения катионита, обьем которого равен 3,0 м3, составляет:
Еп =3900г-экв:3 м3 =1300 г-экв/ м3.
 10. Определить суточную потребность городского водопровода в период паводка: а) в коагулянте, содержащем 85% Al2(SO4)3 ; б) в хлор-газе (в нм3 и в пересчёте на 40-литровые баллоны, под давлением 8 ат). Расход коагулянта составляет 120 г/м3 воды, хлора - 2 мг/л. Производственные потери коагулянта – 3%. Производительность водопровода – 150 000 м3/сут.
10. Определить суточную потребность городского водопровода в период паводка: а) в коагулянте, содержащем 85% Al2(SO4)3 ; б) в хлор-газе (в нм3 и в пересчёте на 40-литровые баллоны, под давлением 8 ат). Расход коагулянта составляет 120 г/м3 воды, хлора - 2 мг/л. Производственные потери коагулянта – 3%. Производительность водопровода – 150 000 м3/сут.
Решение. Суточная потребность в коагулянте:
0,120·150000=18000 (кг).
В пересчёте на технический коагулянт, содержащий 85% Al2(SO4)3, учитывая производственные потери (3%):
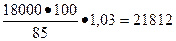 (кг).
(кг).
Суточная потребность хлор-газа:
0,002х150000=300 (кг), или 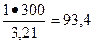 нм3,
нм3,
где 3,21 – масса 1 м3хлор-газа (в кг), при н.у. (см. приложение 1).
При давлении 8 ат хлор-газ сжижается и плотность его равна 1,5 кг/л (см. приложение 1). Отсюда масса хлора в объёме 40-литрового баллона составляет:
40х1,5=60 (кг).
Потребность городского водопровода в 40-литровых баллонах жидкого хлора (в сутки) будет равна:
300:60,0=5.
По аналогии с рассмотренными типовыми примерами решаются и предлагаемые ниже задачи.
2.5. Задачи для самостоятельного решения
1. Для удаления карбонатной жесткости, обусловленной бикарбонатом кольция Ca(HCO3)2, используют один из следующих реагентов: едкий натр, гашёную известь, тринатрийфосфат. Какое из названных веществ окажется наиболее эффективным, если взять их в одинаковых количествах? Ответ мотивировать уравнениями реакций и соответствующими расчётами.
Ответ. Наиболее эффективным является гидроокись кальция Ca(OH)2.
2 Почему для регенерации катионита его промывают раствором хлористого натрия, а затем водой? Можно ли регенерировать катионит, промывая его раствором хлористого магния?
3. К 200 мл исследуемой воды было прилито 20 мл 0,01 н. раствора перманганата калия KMnO4, Определить окисляемость воды в пересчёте на кислород.
Ответ. 2,23 мг/л кислорода.
4 При определении общей жесткости воды (Жо) комплексометрическим методом на титрование 200 мл исследуемой воды пошло 5,5 мл 0,1 н. раствора трилона Б. Вычислить общую жесткость воды (в мг-экв/л).
Ответ. Жо=2,75 мг-экв/л.
5 Общая жесткость воды равна 11,7 мг-экв/л. Определить постоянную жёсткость воды (Жн), если при определении временной жесткости (Жк) на 100 мл испытуемой воды при титровании пошло 6,5 мл 0,1 н. раствора соляной кислоты.
Ответ. Жн=5,2 мг-экв/л.
6. Чему равна жесткость природной воды, если содержание ионов магния в ней составляет 121,6 мг/л?
Ответ. 10 мг-экв/л.
7. Определить жесткость воды (Жо), если в 1 л её содержится 0,1002 г ионов Ca2+ и 0,03648 г ионов Mg2+. Ответ. Жо=8,0 мг-экв/л.
8. Вода содержит 0, 12 г/л растворённого бикарбоната кальция. Сколько нужно прибавить извести [Ca(OH)2] к 100 мл воды, чтобы осадить бикарбонат в виде карбоната?
Ответ. 5,5 мг
9. В 2 л воды содержится 3 г бикарбоната кальция, 0,29 г бикарбоната магния и 1,4 г сульфата кальция. Сколько натриевого мыла (соли стеариновой кислоты) будет перерасходовано за счет жесткости при использовании 1000 л воды? Образование кальциевого (или магниевого) мыла протекает по реакции:
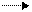 2C17H35COONa+Ca(HCO3)2 (C17H35COO)2Ca+2NaHCO3
2C17H35COONa+Ca(HCO3)2 (C17H35COO)2Ca+2NaHCO3
Ответ. 9,46 кг.
10. В 5,5 т технического коагулянта содержится 4675 кг Al2(SO4)3. Определить процентное содержание Al2(SO4)3 в глиноземе.
Ответ. 85%.
11. Определить суточную производительность городского водопровода, если потребность хлор-газа составляет 12,5 нм3/сут из расчета 0,8 мг/л.
Ответ. 50156 м3 воды в сутки.
12. Определить суточную потребность городского водопровода в коагулянте (в т) и хлор-газа (в кг и нм3), если производительность его 35000 м3/ч. Расход коагулянта составляет 80 г/м3 воды, хлора-1 мг/л. Содержание Al2(SO4)3 в техническом коагулянте (глиноземе)- 80%; потери при транспортировке и хранении коагулянта составляют 5%.
Ответ. Суточная потребность водопровода: a) в коагулянте- 8,82 т; б) в хлор-газе- 35 кг, или 10,9 нм3.
13. Определить (в м3) суточную потребность катионита (без регенерации) для умягчения воды. Объемная скорость течения воды- 5м3/ч, жесткость воды- 8,5 мг-экв/л, емкость поглощения катионита (Е)- 1150 г-экв/м3.
Ответ. 0,9 м3/сут. катионита (без регенерации).
14. Через катионитовый фильтр, рабочий объем которого равен 2,15 м3, пропускают воду, жесткость которой до фильтрования составляет 7,5 мг-экв/л. Объемная скорость течения воды- 6,0 м3/ч. Определить емкость поглощения катионита (в г-экв/м3), если фильтр работает без регенерации трое суток.
Ответ. Е= 1510 г-экв/м3.
15. Определить время работы (в часах) буферного катионита (КБ-4), если рабочий объем фильтра вмещает 5,5 т катионита, емкость поглощения которого равна 0,9 г -экв/кг. Объемная скорость течения воды - 10 м3/ч, жесткость воды - 12 мг-экв/л.
Ответ. 41,25 ч (без регенерации).
16. Жесткость природных источников имеет сезонные колебания. Так, в 2 м3 воды в среднем течении Волги в марте содержится 88 г-ионов Са2+ и 51 г-ионов Mg2+ , а в мае – 17 г-ионов Са2+ и 6,4 г-ионов Mg2+. Определите общую жесткость волжской воды в эти месяцы.
18. Анализ 25 мл природной воды показал наличие в ней 42,5 мг Са2+, 6,25 мг Mg2+ и 60 мг НСО3-. Рассчитайте некарбонатную жесткость воды.
19. Определите постоянную жесткость воды (Жн), если на титрование карбонатов, содержащихся в 250 мл воды израсходовано 14 мл раствора НCl, молярная концентрация которого 0,1 моль/л, а общая жесткость (Жо) равна 5,2 ммоль/л
20. На окисление органических соединений, содержащихся в воде, израсходовано 2 мл раствора перманганата калия концентрацией 0.007 ммоль / л. Определите окисляемость воды (в пересчете на кислород).
21. На станцию водоочистки производительностью 30000 м3/сут поступает вода с повышенной цветностью и мутностью. Определите недельный расход раствора коагулянта и флокулянта (полиакриламида) станцией, если расчетная доза первого 30 мг/л, второго – 0,8 мг/л, а производственные потери их составляют 8%. Рабочие концентрациикоагулянта 15%, флокулянта 0,3% (по массе)
22. Концентрация коагулянта в расходных баках станции водоочистки равна 10% (считая массу безводного продукта). Определите суточный расход раствора коагулянта, если его доза для данного типа воды 25 мг/л, производительность станции 30000 м3/сут. (Коагулянт – железный купорос 95 5-ной чистоты).
23. Определите суточную потребность станции водоочистки в коагулянте, содержащем 0,98 массовых долей Fe3SO4.7 H2O, если расчетная доза безводного коагулянта (ГОСТ 2874-73 «Питьевая вода») 80мг/л, производительность станции 100 000 м3/сут, а производственные потери коагулянта составляют 4%.
24. Вода, используемая для хозяйственно-бытовых нужд, с содержанием фтора менее 0.5 мг/л должна подвергаться фторированию. Определите массу 2.5% - ного раствора NaF, приготовленного из фторида натрия с массовой долей основного вещества 0.9, необходимого для фторирования 1000м3 природной воды с содержанием фтора 0.4 мг/л до санитарной нормы 0.8 г/м3.
25 Определите время работы колонки с натриевым катионитом до регенерации, если в нее поступает вода с жесткостью 5.0 ммоль/л и скоростью потока 10 м3/ч. Объем катионта 2 м3, его емкость поглощения 1200 моль/м3.
26 Определите емкость поглощения катионита (Еп), если высота его слоя в колонке 1.6 м, диаметр колонки 1.5 м, время работы без регенерации 75 часов. Жесткость воды, поступающей в фильтр, 5 ммоль/л, остаточная жесткость 0.02 ммоль/л, объемная скорость потока 8 м3/ч.
27. Сколько потребуется универсального катионита КУ-2, емкость поглощения (Еп) которого 2.2 моль/кг, для обеспечения (без учета регенерации) беспрерывной двадцатидневной работы фильтров производительностью 70 080 м3 воды в год. Среднюю жесткость исходной воды принять равной 6.1 ммоль/л.
3. Технико-экономические показатели химических производств
Практическая целесообразность и рентабельность химического производства определяются технико-экономическими показателями, важнейшими из которых являются расходный коэффициент сырья и выход продукта, производительность аппарата, интенсивность процесса (аппарата).
3.1. Расходный коэффициент сырья и выход продукта.
Расходным коэффициентом сырья (Fp) называется количество каждого вида сырья (кг, т), затраченное на единицу готового продукта, полученного в процессе данного производства.
3.1.1. Примеры решения типовых задач
1. Определить расходный коэффициент аммиака в производстве азотной кислоты (без учета производственных потерь).
Решение. Процесс окисления аммиака в азотную кислоту протекает по схеме:
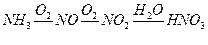
17 кг1 63 кг
На образование 63 кг азотной кислоты теоретически расходуется 17 кг аммиака, а для получения 1 кг кислоты расход аммиака составит:
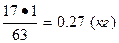
Следовательно, расходный коэффициент (Fp) аммиака равен 0,27 кг.
3.1.2. Выход продукта (η) — это отношение количества практически полученного продукта — Gn (в кг) к теоретически возможному— GT (в кг), выраженное в процентах:
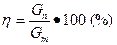 . (7)
. (7)
Если производственный процесс состоит из нескольких стадий и каждой из них соответствует определенный выход, то общий выход готового продукта по всему процессу в целом определяется следующим уравнением:
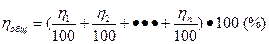 , (7а)
, (7а)
где η1 , η2 , ηn - выход продукта по отдельным стадиям процесса производства.
Чем выше выход продукта, тем экономичнее производство. Снижение выхода продукта обусловлено загрязненностью сырья, потерей сырья в процессе транспортировки, негерметичностью аппаратуры, протеканием побочных реакций, обратимостью реакций.
3.1.3. Примеры решения типовых задач
1.Теоретически 17 кг аммиака NH3 при окислении дают 63 кг азотной кислоты HNO3. Практически же получено 54 кг кислоты. Определить выход азотной кислоты.
Решение. По условию G n =54 кг, a G m = 63 кг, по уравнению (7).
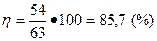 .
.
2. При получении серной кислоты контактным способом на 1 т сжигаемого колчедана с содержанием 42%' серы практически получается 1,2 т олеума, содержащего 20%
«свободного» ангидрида SO3. Определить процент выхода серной кислоты.
Решение. Процесс образования серной кислоты протекает по схеме:
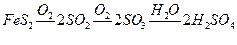 .
.
Из 1 т колчедана, содержащего 42%' серы S, теоретически серной кислоты можно получить:
 ,
,
где 98,1 и 32,1 — молекулярные массы соответственно серной кислоты и серы; 420 — содержание серы в 1 т колчедана.
В 100 кг 20%-ного олеума содержится 80 кг H2SO4 и 20 кг серного ангидрида SO3, которые эквивалентны
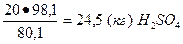 ,
,
где 80,1 — молекулярная масса SO3, a 98,1 — молекулярная масса H2SO4.
100 кг 20%-ного олеума эквивалентны (24,5+80,0) кг H2SO4, a
1200 кг, «G п кг «
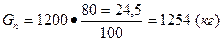 .
.
Отсюда выход серной кислоты (η) равен:
 .
.
3. Согласно материальной отчетности на производство 1 т 65%-ной азотной кислоты HNO3, полученной окислением аммиака, расходуется 186,2 кг аммиака NH3. Рассчитать: а) выход азотной кислоты; б) теоретический и практический расходные коэффициенты сырья по аммиаку.
Решение. В 1 т 65%-ной азотной кислоты HNO3 содержится 650 кг чистой кислоты Gп. Процесс получения азотной кислоты HNO3 протекает по схеме:
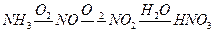 .
.
17 кг 63 кг
Расходные коэффициенты по аммиаку будут равны:
а) теоретический
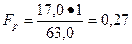
б) практический
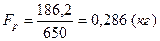 .
.
Это значит, что на получение 1 кг 100%-ной азотной кислоты HNO3 расходуется практически 0,286 кг аммиака NH3.
Для вычисления выхода азотной кислоты по аммиаку рассчитаем, сколько кислоты теоретически должно получиться из 186,2 кг аммиака.
17 кг аммиака NH3 дают 63 кг кислоты HNO3, a
186 кг „ „ х кг»»
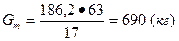 100%-ной HN03.
100%-ной HN03.
В пересчете на 65%-ную HNO3
.
Выход азотной кислоты HNO3 (η) будет равен:
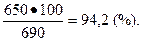
4. Из 320 т колчедана FeS2, содержащего 45% серы S, было получено 270 т сернистого газа SO2. Вычислить расходный коэффициент и выход SO2 по сере.
Решение. Процесс получения газа SO2 из пирита FeS2 протекает по схеме:
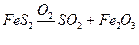 .
.
Определить количество серы в 320 т колчедана:
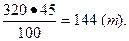
Расходный коэффициент серы Fр будет равен:
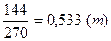 .
.
Из 144 т серы теоретически сернистого газа SO2 должно получиться:
S + O2=SO2.
32 т серы S дают 64 т газа SO2, a
144 т „ „ я GT т»»
Отсюда
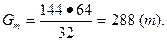
Выход газа SO2 по сере будет равен:

3.2. Производительность и мощность аппарата
Производительность аппарата (П) - это количество готового продукта Gп, практически выработанного данным аппаратом в единицу времени при данных условиях процесса производства, выражается в кг/ч (т/сут).
 . (8)
. (8)
3.2.1. Примеры решения типовых задач.
1. В контактном аппарате в течение 12 ч. окисляется 180 т ангидрида SO2, степень окисления 98,5%. Определить производительность аппарата в кг/ч.
Решение. Пользуясь уравнением (11), находим производительность контактного аппарата:
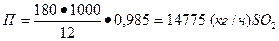 (кг/ч) SO2.
(кг/ч) SO2.
2. Определить годовую (365 дней) производительность колонны синтеза аммиака в расчете на 100%-ный NH3 (в тыс. т ), если за 8 ч вырабатывается 60000 кг 99%-ного аммиака.
Решение. За сутки 99%-ного аммиака вырабатывается:
 .
.
Годовая производительность колонны синтеза аммиака составляет:
180.365=65700 (т) NH3 99%-ного.
Производительность колонны (в расчете на 100%-ный аммиак) равна:
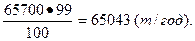
3. Определить суточную производительность меха-нической обжиговой печи {в т), если в течение часа обжигается 1900 кг природного колчедана, содержащего 21,5% пустой породы. В огарок отходит 2% колчедана FeS2.
Решение. Содержание FeS2 в природном колчедане составляет:
100-21,5=78,5(%).
Отсюда в 1900 кг колчедана содержится FeS2:
1900 . 0,785=1491,5 (кг).
Отходит в огарок (2%):
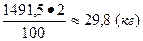 FeS2.
FeS2.
Суточная производительность обжиговой печи (в т) равна:
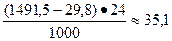 (т/сут ) FeS2.
(т/сут ) FeS2.
4. Производительность колонны синтеза аммиака среднего давления составляет 150 т/сут аммиака NH3. Определить, сколько азота N2 и водорода Н2 (в нм3 ) потребуется в сутки для работы пяти колонн синтеза, если на 1 т аммиака NH3 расходуется 2850 нм5 азотно-водородной смеси.
Решение. Процесс синтеза аммиака протекает по реакции:
N2+3H2↔2NH3+Q.
Из четырех объемов азотно-водородной смеси на долю азота приходится один объем, а на водород- три объема.
Для обеспечения работы пяти колонн синтеза в течение суток (с учетом условий задачи) потребуется:
азота
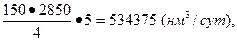
водорода
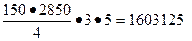 (нм3/сут).
(нм3/сут).
Производительность аппарата при оптимальных условиях процесса называется мощностью (N) аппарата.
Попт=N (кг/ч) (9)
3.3.Интенсивность аппарата (процесса)
Интенсивность аппарата (I) — это производительность, отнесенная к единице полезной площади (Sn) или к единице полезного объема (V п ):
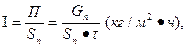 (10)
(10)
 (10а)
(10а)
3.3.1. Примеры решения типовых задач
1. Объем контактной массы в аппарате окисления сернистого газа в серный ангидрид составляет 14,5 м3. Произ-водительность контактного аппарата — 360 т/сут (по H2SO4). Определить интенсивность процесса окисления.
Решение. Пользуясь уравнением (10а), определяем интенсивность окисления:

2. Доменная печь объемом 2700 м3 выплавляет в год 1642,5 тыс. т чугуна. Определить производительность домны и интенсивность процесса выплавки чугуна.
Решение. Производительность (П) домны (в. т/ч) равна:
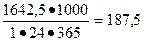
Интенсивность процесса (I) выплавки чугуна равна:
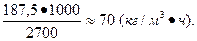
3. В механической печи системы ВХЗ обжигают 1,6 т/ч колчедана, содержащего 40% серы S. Печь имеет 7 рабочих подов, площадь каждого 20 м2. Определить интенсивность обжига на 1 м2 пода печи в сутки. Расчет произвести на 45%-ный колчедан.
Решение. Количество сжигаемого в печи колчедана (в пересчете на колчедан, содержащий 45% серы S) будет равно:

Интенсивность обжига (I) составляет:
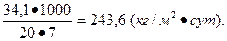
4. В коксовую камеру длиной - 14 м, высотой - 4 м и шириной - 0,4 м загружают 16 т каменного угля, который занимает 80% объема камеры. Процесс коксования угля осуществляется в течение 14 ч. Рассчитать производительность коксовой камеры и интенсивность процесса коксования.
Решение. Объем коксовой камеры равен:
V= 14,0 . 4,0 . 0,4 = 22,4 (м3).
Полезный объем камеры (V п ) составляет:
22,4 . 0,8=18 (м3).
Производительность коксовой камеры равна:
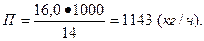
Интенсивность процесса коксования угля составляет:
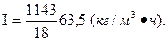
5.Производительность печи КС равна 8,33 т/ч (по флотационному колчедану). Определить интенсивность процесса обжига в кг/м3. сут и сравнить с интенсивностью этого процесса в печи ВХЗ. Площадь решетки печи - 20 м2, высота кипящего слоя (h) — 1,5 м.
Решение. Полезный объем печи КС:
V п = 20 . 1,5=30,0
Интенсивность процесса обжига колчедана вычисляется по формуле (10а):
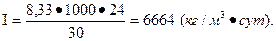
При сопоставлении интенсивности процесса обжига колчедана, мы видим, что интенсивность обжига в печах КС в 6664: 243,6≈27 раз выше, чем в печах ВХЗ.
3.4.. Вопросы для повторения
1. Что называется расходным коэффициентом сырья?
2. Дайте определение понятию «выход продукта».
3. Какая величина называется «производительностью» аппарата? От каких факторов она зависит?
3.Что называется «мощностью» аппарата?
4.Дайте определение понятию «интенсивность» аппарата (процесса).
5.Укажите, какие факторы влияют на основные технико-экономические показатели химического производства: на выход продукта и производительность аппарата. Ответ мотивируйте.
3.5. Задачи для самостоятельного решения
1. Вычислите теоретические расходные коэффициенты для получения сульфатным методом 1т 36%-ной соляной кислоты.
2. Определите расходный коэффициент технического альдегида (99%-ной чистоты) для получения 1 т уксусной кислоты:
СН3 СНО+0,5 О2→СН3СООН,
если выход кислоты по альдегиду 93,5%.
3. Определите расходные коэффициенты сырья для производства 1т фосфата аммония (NH4)3PO4, если исходные продукты: 55%-ная фосфорная кислота; 98%-ный аммиак, влаги – 2 %.
4. Вычислите расходные коэффициенты на 1 т оксида серы (IV), если содержание серы в руде серного колчедана 45%, влаги – 1,5%, воздух на обжиг колчедана подают с избытком в 1,5 раза.
5. Негашеная известь содержит 95% окисла СаО, 1,2% известняка СаСОз и 3,8% примесей. Получается она обжигом известняка, содержащего 85% СаСО3. Рассчитать: а) расходный коэффициент известняка указанного состава на 1 т СаО; б) степень обжига известняка.
Ответ, а) Расходный коэффициент - 2,03 т известняка, содержащего 85% карбоната СаСОз; б) степень обжига - 98,8%'.
6. При химическом обогащении марганцевой руды через шлам, в составе которого 15% Mn (по массе), пропускают оксид серы (IV), затем добавляют дитионат кальция и в конечном итоге Са(ОН2). При этом происходит следующее превращение
MnO2→MnSO4→MnS2O6→Mn(OH)2
Напишите уравнения соответствующих реакций и определите расходные коэффициенты этого процесса в расчете на 100 т шлама.
7. При производстве серной кислоты контактным способом из 30 т колчедана, содержащего 42,4% серы, получено 33,6 т серной кислоты H2SO4. Какой процент это составляет от теоретически возможного выхода?
Ответ. 86,2%'.
8. На химическом заводе для получения кальциевой селитры 10 т мела обработали азотной кислотой. При этом выход селитры составил 85%. Определить, сколько селитры было получено.
Ответ. 13940 кг.
9. При обработке 1 т фосфорита, содержащего 62% третичного фосфата кальция Саз(РО4)2, серной кислотой было получено 727,2 кг суперфосфата:
Ca3(РO4)2+2H2SO4 = Ca (H2PО4)2+2CaSO4.
Определить выход суперфосфата и расходный коэффициент руды.
Ответ. Выход суперфосфата - 90%'; практический расходный коэффициент руды-1,37.
10. Реакция получения дивинила из этилового спирта по способу С. В. Лебедева протекает по уравнению:
2С2Н5ОН→СН2=СН—СН = СН2 + 2Н2О + Н2.
Выход дивинила составляет 75%. Вычислить, сколько килограммов дивинила можно получить из 2000 л 96%-ного спирта С2Н5ОН, плотность которого 0,8 кг/л.
Ответ. 676,1 кг дивинила.
11. Сернокислотная установка башенной системы объемом 740 м3 дает 150 т 75%-ной серной кислоты H2SO4 в сутки. Определить производительность установки (П) (в кг/ч ) по безводной серной кислоте H2SO4
Ответ. П=4687,5 кг/ч.
12. Производительность печи для обжига серного колчедана составляет 30 т в сутки. Выход сернистого газа — 97,4% от теоретического. Сколько тонн SO2 производит печь в сутки, если содержание серы в колчедане 42,4%?
Ответ. 24,8 т/сут SO2.
13. Годовая производительность установки по производству уксусной кислоты 20 тыс.т в год. Вычислите производительность в час, если цех работает 365 дней в году, из низ 32 дня отводятся на ремонты, потери производства составляют 4%.
14. Подсчитайте интенсивность полимеризатора сополимеризации дивинила со стиролом, если его объем 20 м3, производительность 2160 кг полимера в сутки.
15.Продукционная башня - денитратор в нитрозном способе производства серной кислоты имеет высоту 16 м и диаметр 5,5 м. Полезный объем башни составляет 85%. Съем кислот- 90 т в сутки. Определить интенсивность процесса.
Ответ. 11,6 кг/м3ч H2SO4.
16.Годовая производительность домны составляет 1800 тыс. т чугуна. Определить интенсивность процесса выплавки чугуна, если полезный объем печи составляет 2700 м3.
Ответ. 76, 1 кг/м3ч.
17.Подсчитать суточную производительность печи КС, если полезный объем печи равен 100 м3, а интенсивность обжига пирита FeS2 1000 кг/м3-сут.
Ответ. П = 100 т/сут (по FeS2).
18.Объем колонны синтеза аммиака, занятый катализатором, составляет 1,5 м3. Производительность колонны 7500. Рассчитать: а) годовую производительность колонны синтеза аммиака (в т ); б) интенсивность процесса синтеза аммиака.
Ответ. П = 657. 102т NH3 в год; I = 5000 .кг/м 3 . ч
Приложение 1
Плотность некоторых веществ
| Наименование вещества | Плотность | Наименование вещества | Плотность |
| 1.Твердые тела, кг/м3 | |||
| Алюминий | Огнеупоры | 1900-2900 | |
| Медь | Бетон | ||
| Чугун | Древесный уголь | 500-800 | |
| Сталь | Апатит | ||
| Колчедан | Стекло оконное | ||
| Известняк | Стекло органическое | ||
| Песок | Полиэтилен | ||
| Глина(каолин) | Пенопласт | ||
| Каменный уголь | Пробка | ||
| Кокс | Платина | ||
| 2. Жидкости, кг/м3 | |||
| Вода (40С) | Толуол | ||
| Нефть | Ртуть(00С) | ||
| Бензин | Спирт этиловый | ||
| Керосин | Глицерин | ||
| Бензол | Эфир | ||
| 3. Газы, кг/м3 при н.у. Плотность сжиженного газа, кг / л | |||
| азот | 1,25/ 0,81 | окись углерода | 1,25/0,8 |
| аммиак | 0,77/ 0,66 | сернистый газ | 2,93/1,46 |
| воздух | 1,29/0,86 | сероводород | 1,54/0,96 |
| кислород | 1,43/1,14 | углекислый газ | 1,98/1,19 |
| водород | 0,99/0,07 | хлор | 3,21/1,47 |
Приложение 2
Мольный объем некоторых газов
| Наименование газа | Объем, м3/кмоль | Наименование газа | Объем, м3/кмоль |
| Азот | 22,40 | Окись азота | 22,39 |
| Аммиак | 22,09 | Кислород | 22,39 |
| Аргон | 22,40 | Метан | 22,37 |
| Ацетилен | 22,14 | Окись углерода | 22,40 |
| Воздух | 22,40 | Сернистый газ | 21,89 |
| Водород | 22,43 | Сероводород | 22,16 |
| Водяные пары | 22,12 | Углекислый газ | 22,26 |
| Двуокись азота | 22,37 | Хлор | 22,37 |
Приложение 3
Атомные массы некоторых элементов
| Прядковый номер (заряд ядра) | Название элемента | Символ | Атомная масса | Прядковый номер (заряд ядра) | Название элемента | Символ | Атомная масса |
| Азот | N | 14,00 | Марганец | Mn | 54,9 | ||
| Алюминий | Al | 26,98 | Медь | Cu | 63,55 | ||
| Аргон | Ar | 39,95 | Молибден | Mo | 95,94 | ||
| Барий | Ba | 137,34 | Мышьяк | As | 74,92 | ||
| Бор | В | 10,81 | Натрий | Na | 22,99 | ||
| Бром | Br | 79,90 | Никель | Ni | 58,71 | ||
| Ванадий | V | 50,94 | Олово | Sn | 118,69 | ||
| Висмут | Bi | 208,98 | Платина | Pt | 195,09 | ||
| Водород | Н | 1,008 | Ртуть | Hg | 200,59 | ||
| Вольфрам | W | 183,85 | Свинец | Pb | 207,19 | ||
| Гелий | He | 4,003 | Сера | S | 32,06 | ||
| Железо | Fe | 55,85 | Серебро | Ag | 107,87 | ||
| Иод | I | 126,90 | Стронций | Sr | 87,62 | ||
| Калий | K | 39,10 | Углерод | С | 12,01 | ||
| Кальций | Са | 40,08 | Фосфор | Р | 30,97 | ||
| Кислород | О | 16,00 | Фтор | F | 19,00 | ||
| Кобальт | Со | 58,93 | Хлор | Cl | 35,45 | ||
| Кремний | Si | 28,09 | Хром | Cr | 52,00 | ||
| Литий | Li | 6,94 | Цинк | Zn | 65,37 | ||
| Магний | Mg | 24,31 | Селен | Se | 78,96 |
Список использованных источников
- Основы химической технологии/ Под ред. проф. И.П. Мухленова.- М.: Высшая школа, 1991.- 463 с.
- Соколов Р.С. Химическая технология. Том 1.- М.: Владос, 2000.- 363 с
- Соколов Р.С. Химическая технология. Том 2.- М.: Владос, 2000.- 442 с
- Общая химическая технология. Часть 1/ Под ред. проф. И.П. Мухленова.- М.: Высшая школа, 977.- 285с.
- Общая химическая технология. Часть 2/ Под ред. проф. И.П. Мухленова.- М.: Высшая школа, 1977.-261с.
- Решетников П.А., Н.Я. Логинов. Сборник примеров и задач по основам химической технологии.- М.: Просвещение, 1973.- 207с.
Подписано в печать 28.04.2005г. Формат 60 84 1/6.
Усл. п. л. 3.49, уч.-изд. л. 3.0.
Тираж 50 экз. Заказ № 82.
________________________________________________
Издательство ВСГТУ. Г. Улан-Удэ, ул.Ключеская, 40в.
.
Дата публикования: 2015-10-09; Прочитано: 6245 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
