 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методы выделения и очистки ферментов
|
|
Начальный этап выделения ферментов - это получение экстрактов из предварительно измельченного биологического материала - муки, солода, проросших семян, какой-либо животной ткани, бактериальной массы, мицелия гриба. В такой экстракт переходят различные белки и в том числе ферменты.
Очень часто при изучении действия ферментов пользуются так называемыми гомогенатами. Для получения гомогената отмытую бактериальную массу, мицелий, растительную или животную ткань измельчают в ступке или в приборе, который называется гомогенизатором. При этом добавляют воду или буферный раствор, а для лучшего разрушения клеток - мелкоизмельченное стекло, мельчайшие стеклянные бусы или кварцевый песок. Получается кашица, которая носит название гомогенат. Эта кашица содержит обрывки клеток, их ядра, хлоропласты листьев и другие органеллы клеток (митохондрии и пр.), пигменты, различные растворимые белки и т. д.
Измельчение суспензии клеток в воде или буферном растворе может быть также произведено путем воздействия на них ультразвуком в специальном приборе, называемом ультразвуковым дезинтегратором. Этот способ в настоящее время применяется очень широко, особенно для разрушения бактериальных клеток. Однако в этом случае нужно подобрать такой режим обработки клеток ультразвуком, при котором не будет происходить инактивирование ферментов. Хорошим способом разрушения микробов является также продавливание замороженных клеток под большим давлением через металлический капилляр.
Гомогенат далее может быть подвергнут так называемому дифференциальному центрифугированию, т.е. центрифугированию при различной увеличивающейся скорости. Так, например, можно начать центрифугирование при 1500 g (единица ускорения, вызванного гравитацией), т. е. при ускорении, превышающем ускорение силы тяжести в 1500 раз. После отделения частиц, осевших на дно центрифужных стаканчиков, центрифугируют при 20 000 g, затем при 40 000 g и т. д.
При 1500 g в осадок переходят хлоропласты (частицы, содержащие хлорофилл), при 20 000 g - митохондрии (частицы, в которых сосредоточены окислительно-восстановительные ферменты клеток). При более сильном центрифугировании, при 40 тыс. g и выше, оседают еще более мелкие частицы, находящиеся в гомогенате. Для того чтобы сохранить целыми отдельные органеллы клетки (митохондрии, ядра и т. д.), к гомогенату при растирании материала и его последующем дифференциальном центрифугировании добавляют 5-8% сахарозы.
Если мы выделили, таким образом, из гомогената ту или иную фракцию субклеточных структур, то фермент, содержащийся в них, может находиться внутри этих структур (хлоропластов, митохондрий и т. д.) в связанном состоянии. Чтобы извлечь из них ферменты, перевести их в раствор, нужно разрушить соответствующие структуры. Обычно это делают путем применения так называемых детергентов. Детергентами называют вещества, обладающие очень высокой поверхностной активностью. Такое вещество, будучи добавлено в небольшом количестве к суспензии тех или иных морфологических структур клетки, быстро их разрушает. Часто в качестве детергентов применяют так называемый «Твип» (это фирменное название производных сорбита и высокомолекулярных жирных кислот) или дезоксихолат.
Другой способ освобождения ферментов, связанных в субклеточных структурах, заключается в попеременном замораживании и оттаивании исследуемой фракции субклеточных структур, выделенных путем дифференциального центрифугирования.
Для получения содержащего ферменты экстракта или гомогената можно использовать воду, буферный раствор, солевой раствор (например, 10%-ный раствор хлорида натрия), смесь глицерина и воды (обычно 40% глицерина и 60% воды) или же органический растворитель (например, ацетон).
Для выделения многих ферментов также пользуются так называемыми ацетоновыми порошками. Этот способ заключается в том, что данный биологический материал, например ткань поджелудочной железы или проросшее зерно, при растирании обрабатывают несколько раз охлажденным ацетоном. При этом удаляется целый ряд веществ жироподобной природы, некоторые смолы, красящие вещества и т. д. После высушивания получается однородный порошок, который затем экстрагируют буферным раствором или другим растворителем и получают таким образом экстракт, содержащий те или иные ферменты. Этот способ хорош, но не для всех ферментов, так как некоторые из них инактивируются ацетоном.
Каким же образом из водного или солевого экстракта, полученного тем или иным способом, можно выделить интересующий нас фермент? Это может быть сделано различными способами.
Наиболее старый способ, который еще в начале прошлого столетия: применили А. Пайен и Ж. Персо для выделения фермента амилазы из водного экстракта, полученного из солода, заключается в осаждении белков спиртом. Для этой цели используют также ацетон. Указанный способ выделения ферментов применяется довольно широко и в настоящее время, в частности для получения препаратов из плесневых грибов. Так, например, некоторые японские фирмы производят препарат грибной амилазы («такадиастаз») следующим образом. Гриб Aspergillus oryzae выращивается на питательной среде определенного состава. Затем отделенный от среды мицелий гриба измельчается и экстрагируется, а из полученного экстракта спиртом определенной концентрации осаждается ферментный препарат. Понятно, что при этом осаждается не одна лишь амилаза, а ряд ферментов и других белков.
Однако данный способ имеет существенный недостаток, который заключается в том, что далеко не все ферменты выдерживают обработку спиртом или ацетоном, так как при этом они денатурируются и теряют свою активность. Для того чтобы избежать денатурации и инактивации ферментов при осаждении их из раствора органическими растворителями, необходимо эту операцию производить при низкой температуре, близкой к температуре замерзания смеси данного растворителя с водой.
Помимо осаждения органическими растворителям и, для выделения ферментов применяется так называемое высаливание. Это очень широко распространенный метод, который постоянно используется в научных исследованиях для получения высокоактивных ферментных препаратов. Высаливание чаще всего производится с помощью сернокислого аммония (NH4)2SO4, добавляемого к исследуемому раствору в возрастающих количествах. Содержащий ферменты раствор вначале насыщают сернокислым аммонием, предположим, до 20% от полного насыщения. При этом выпадает какая-то часть белков и ферментов, осадок отделяют в центрифуге и исследуют на наличие соответствующей ферментативной активности. Раствор далее насыщают сернокислым аммонием например, до 40% от полного насыщения, снова отделяют выпавший осадок и исследуют его ферментативную активность. Оставшийся после центрифугирования раствор насыщают сернокислым аммонием до 60% от полного насыщения и снова отделяют выпавший белковый осадок. Таким образом получают ряд белковых фракций, которые исследуют на наличие в них того или иного фермента.
Важный способ выделения и очистки ферментов - их избирательная адсорбция из растворов. Этот способ, который впервые был применен А. Я. Данилевским и широко использовался Р. Вильштеттером, заключается в том, что содержащийся в растворе фермент адсорбируется определенным адсорбентом, например гидратом окиси алюминия. Метод избирательной адсорбции из раствора применяется в ферментной промышленности для выделения и очистки грибной и бактериальной амилазы. При этом в качестве адсорбента используется крахмал, который является специфическим адсорбентом для этого фермента.
Очень широкое применение в энзимологии для разделения и очистки ферментов получили различные виды избирательной адсорбции в колонках. Для заполнения подобных колонок используют различные адсорбенты.
Если мы имеем стеклянную трубку, которая заполнена тем или иным адсорбентом, например гелем гидроксилапатита, и будем пропускать через нее исследуемый раствор, содержащий различные ферменты, то разные ферменты адсорбируются в разных слоях колонки, как это показано на рис. 1.

Рис. 1. Разделение смеси трех ферментов на адсорбционной колонке
Затем при элюировании колонки соответствующим раствором можно последовательно вымыть ферменты из колонки, собирая отдельные фракции раствора с помощью коллектора фракций и разделяя таким образом содержащиеся в растворе белки и в том числе ферменты.
Особенно хорошим способом разделения ферментов с близкими физико-химическими свойствами оказалась ионообменная хроматография на колонках из различных ионообменных смол и различных производных целлюлозы, например карбоксиме-тилцеллюлозы (КМ-целлюлоза) и диэтиламиноэтилцеллюллозы (ДЭАЭ-целлюлоза).
Говоря о различных методах разделения ферментов на колонках, нужно отметить также получивший широкое применение метод гель-фильтрации. Особенно часто при этом применяют препараты с фирменным названием сефадекс. Сефадексы представляют собою производные декстрана. Как известно, декстран является высокомолекулярным полисахаридом, образуемым разными видами микроорганизмов Leuconstoc при развитии на растворах сахарозы. Молекула декстрана состоит из цепочек, образованных остатками глюкозы, связанными между собой 1: 6-связями. Молекулярная масса декстрана достигает миллиона и более. Сефадексы получают из декстрана путем его химической обработки, в результате которой в молекуле образуется разветвленная сеть поперечных связей и вещество становится нерастворимым в воде, но легко в ней набухает.

Применение сефадексов для разделения белков и ферментов основано на следующем. Допустим, что мы имеем хроматографичсскую колонку, заполненную пористыми частицами сефадекса, окруженными водной оболочкой, и уравновешенную каким-нибудь буферным раствором. Вносим в нее раствор, содержащий смесь двух веществ разной молекулярной массы, например соль и белок. При фильтровании через гель сефадекса низкомолекулярное вещество медленно диффундирует через поры набухших в воде частиц сефадекса.
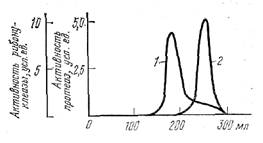
Рис. 22. Разделение на сефадексе G-75 рибонуклеазы и протеаз из экстракта поджелудочной железы 1 - рибонуклеаза; 2 - протеазы
Более высокомолекулярное вещество, в данном случае белок, быстрее просачивается между частицами сефадекса и может быть получено в свободном от низкомолекулярных примесей виде (рис. 21).
Если затем продолжить промывание колонки тем же буферным раствором, то можно удалить медленно диффундирующее низкомолекулярное вещество, в данном случае соль, и таким образом регенерировать колонку. Разделение белков па сефадексах часто называют разделением по принципу «молекулярных сит».
Шведская фирма «Рharmacia» выпускает сефадексы с разными размерами частиц и с разной частотой поперечных связей. Они различаются своей разделяющей способностью. Особенно широко сефадексы применяются вместо диализа для обессоливания ферментных растворов. Однако они с успехом используются также для разделения белков. Так, например, на рис. 22 представлены результаты разделения на колонке из сефадекса G-75 ферментов из экстракта поджелудочной железы рибонуклеазы, расщепляющей рибонуклеиновую кислоту, и протеаз, расщепляющих белки. Наряду с сефадексамн для разделения ферментов широко используются другие «молекулярные сита», известные под фирменными названиями: сефарозы, сефакрилы, ультрагели, биогели.
Для разделения и очистки ферментов в настоящее время очень широко применяется электрофорез в различных гелях - полиакриламидном, агарозном, крахмальном и др., насыщенных буферным раствором. Применение гелей, кроме устранения влияния конвекции, позволяет разделить белки не только по заряду, но и по молекулярной массе и форме молекулы.
Для проявления белков в геле их фиксируют уксусной или трихлоруксусной кислотами и окрашивают амидочерным, кумасси или другими белковыми красителями. Кроме того, для идентификации в геле ферментов используют их активность, окрашивая продукт данной ферментативной реакции специальным реактивом. При этом получаются так называемые зимограммы.
Какие же комбинации указанных нами методов применяются для того, чтобы выделить тот или иной фермент из раствора?
Рассмотрим этот вопрос на примере разработанного в лаборатории энзимологии Института биохимии имени А. Н. Баха АН СССР метода выделения и очистки фермента глютаматдегидрогеназы из одноклеточной зеленой водоросли хлореллы.
В клетках этого организма при выращивании на свету и при использовании в качестве источника азота сернокислого аммония синтезируются две глютаматдегидрогеназы, различающиеся но своей специфичности к коферменту: одна работает как с NAD+, так и с NADР+, а другая только с NADР+. Сочетая определенным образом вышеописанные приемы выделения ферментов, эти глютаматдегидрогеназы можно отделить друг от друга и получить в виде очищенных препаратов.
Сначала выращенные клетки хлореллы разрушают, при этом содержимое клеток переходит в буферный раствор, затем эту смесь центрифугируют при 18 000 g для отделения неразрушенных клеток, грубых частиц и других структур, не содержащих глютаматдегпдрогеназ.
Полученную надосадочную жидкость замораживают при - 10-15°С в течение 12 ч, затем оттаивают и снова центрифугируют на ультрацентрифуге при 110 000 g в течение 1 ч. При этом разрушаются и удаляются комплексы хлорофилла с липопротеидами. Надосадочную жидкость после центрифугирования подвергают дифференциальному высаливанию сернокислым аммонием от 35 до 65% от полного насыщения. Белки, выпадающие в осадок в этой области, отделяют центрифугированием, перерастворяют в минимальном объеме буферного раствора и пропускают через колонку с сефадексом С-25. При прохождении через колонку с сефадексом раствор белка освобождается от сернокислого аммония. Полученный белковый раствор наносят на колонку с ДЭАЭ-целлюлозой, при этом белки с разной степенью прочности связываются с ионообменником. При элюировании колонки буферным раствором возрастающей концентрации происходит разделение белков.
О выходе того или иного фермента судят по его активности во фракциях элюата. В нашем случае глютаматдегидрогеназа, специфичная к NADР+ элюируется при низкой ионной силе буферного раствора, а глютаматдегидрогеназа, работающая с обоими коферментами,- при высокой.
Все более широкое применение для выделения и очистки ферментов находит аффинная хроматография ферментов на колонках, заполненных носителем, который строго избирательно адсорбирует определенный фермент. В качестве примера высокой эффективности аффинной хроматографии ферментов можно привести очистку L-аспарагиназы (3.5.1.1) - фермента, который привлекает к себе пристальное внимание в связи с тем, что он оказался эффективным средством против некоторых форм опухолей. Обычный метод очистки этого фермента из кишечной палочки включает ряд стадий; (тепловая денатурация, осаждение органическими растворителями, гель-фильтрация, колоночная хроматография), причем получаются препараты со сравнительно низкой активностью. Путем аффинной хроматографии экстрактов из кишечной палочки на колонке из ε-аминокапроил- D-аспарагинагарозы за один прием можно получить высокоочищенный препарат L-аспарагиназы с активностью, в 25 - 30 раз более высокой, чем при обычном способе выделения.
Широкое распространение при аффинной хроматографии протеолитических ферментов получили природные ингибиторы ферментов. Их отличает необычайно высокое сродство к ферментам и высокая специфичность. Эти качества позволяют использовать иммобилизованные ингибиторы для выделения ферментов непосредственно из экстрактов органов и тканей или из культуральной жидкости микроорганизмов, минуя многие промежуточные стадии. В результате удается получить в чистом виде ферменты, присутствующие в исходном материале в малых количествах, с высоким выходом, достигающим 80 - 90%. Аффинная хроматография ферментов и других белков, открывает новые пути для совершенствования биохимической, и химической технологии и создания новых автоматизированных, методов биохимического анализа.
При выделении и очистке ферментов особенно важное значение имеет низкая температура. При обычной температуре лаборатории, многие ферменты денатурируются и частично или полностью теряют свою активность, поэтому желательно работать с ферментами в специально оборудованных холодных комнатах.
При получении какого-либо очищенного ферментного препарата иногда важно выделить его в кристаллическом состоянии. В настоящее время большое число ферментов получено в виде белковых кристаллов. Очищенный фермент в течение некоторого времени может быть сохранен в виде раствора. Однако хранить его нужно при пониженной температуре, лучше всего в замороженном состоянии, даже при этом условии активность некоторых ферментов сохраняется недолго. Хорошим способом хранения очищенных ферментных препаратов, защищающим их от денатурации и снижения активности, является хранение при пониженной температуре в насыщенном растворе сернокислого аммония или в глицерине.
Очищенный раствор фермента или кристаллический ферментный препарат может быть высушен. Для этого применяют различные способы. В ряде случаев с успехом может быть применена вакуум-сушка в присутствии какого-либо водопоглощающего вещества, лучше всего - Р2О5. Однако наилучшим способом является сушка путем лиофилизации, т. е. из замороженного состояния. При сушке путем лиофилизации белки и ферменты в подавляющем большинстве случаев прекрасно сохраняют все свои свойства.
Если получен препарат какого-то фермента, то возникает вопрос, каким образом мы можем убедиться в том, что этот фермент является действительно чистым, однородным, а не представляет собой смесь разных белков.
Существует ряд методов для определения степени чистоты и однородности белков. Широко используемый способ определения однородности белков, а следовательно, и ферментов - это электрофорез.
Фермент лактатдегидрогеназа, принадлежащий к классу окислительно-восстановительных ферментов, катализирует обратимую реакцию превращения молочной кислоты в пировиноградную кислоту:
Этот фермент можно выделить из сердца теленка в виде кристаллического препарата. Но если этот кристаллический препарат подвергнуть электрофорезу при рН 5,5 и определенной ионной силе, то он дает два пика. Таким образом, при электрофорезе он разделяется на два белка и, следовательно, является неоднородным.
Особенно высокой разделяющей способностью обладает метод изоэлектрической фокусировки белков, разработанный Свенссоном и Востербергом. Этот метод позволяет разделить белки, отличающиеся своими изоэлектрическими точками. Фракционирование белков проводят в колонке, заполненной синтетическими амфолинами - смесью алифатических полиаминов поликарбоновых кислот. Сочетание аминных и карбоксильных групп каждого отдельного амфолина смеси определяет характер его диссоциации. Под действием электрического поля амфолины распределяются по высоте колонки в строго определенной последовательности и создают линейный градиент рН. В электрическом поле колонки молекулы внесенного в нее белка перемещаются к аноду или катоду. При этом они проходят зоны с разными значениями рН. В зоне, где рН точно соответствует значению изоэлектрической точки белка, его молекулы становятся электронейтральными их движение прекращается - происходит фокусирование белка. В разных зонах колонки фокусируются белки с разными значениями изоэлектрических точек. Метод позволяет разделить белки, изоэлектрические точки которых различаются на 0,02 рН.
Очень важным способом определения однородности белков, а следовательно, и ферментов является их исследование в ультрацентрифуге. Принцип работы ультрацентрифуги заключается в том, что раствор, содержащий белковые молекулы, подвергается очень мощному воздействию центробежной силы, превышающей приблизительно в 500 тыс. раз силу земного притяжения (g). При этом сначала осаждаются более тяжелые молекулы, затем - менее тяжелые. Таким образом, с помощью ультрацентрифуги можно разделить белки, различающиеся по своей молекулярной массе. Аналитическая ультрацентрифуга снабжена оптическим устройством, регистрирующим результаты анализа в виде кривой при прохождении света через; специальные ячейки, содержащие раствор исследуемого белка.
Когда мы имеем дело с белком, который при данных условиях однороден по молекулярной массе, то при испытании его в ультрацентрифуге на кривой получается один симметричный пик. Если же на диаграмме получаются два пика или один несимметричный, то это значит, что данный белковый препарат представляет собой смесь по меньшей мере двух разных белков.
Ультрацентрифугирование применяется как для определения однородности белковых препаратов, так и для определения молекулярной массы белков. Для определения однородности белков; и ферментов широко используются также разные виды хроматографии. Это уже рассмотренная нами ранее хроматография на колонках из геля трикальцийфосфата и гидроксилапатита, а также на колонках из КМ-целлюлозы и ДЭАЭ-целлюлозы. Для того чтобы, установить, является ли данный белок однородным, необходимо сочетать разные методы. Совершенно очевидно, что все эти методы должны сопровождаться определением ферментативной активности. По мере очистки активность фермента будет возрастать пока, наконец, не достигнет максимальной величины, свойственной однородному, чистому ферменту.
Дата публикования: 2015-10-09; Прочитано: 7665 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
