 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Прочие отрасли промышленности
|
|
В других отраслях химической промышленности без метилового спирта не обходится производство уксусной кислоты, карбамидных смол, синтетических каучуков (~ 11% от общего объема). В металлургии и в производстве аммиака метанол является важным, экономически эффективным сырьем для получения водорода и синтез-газа, которые необходимы в данных отраслях. Метиловый спирт широко используется для очистки от вредных соединений азота, который содержится в сточных водах. Многими предприятиями ведутся исследования в области применения метанола как источника энергии, в качестве газового топлива, моторного топлива и как составляющего компонента автомобильного бензина. Автомобильный бензин благодаря добавке метанола обладает улучшенными антидетонационными свойствами, в результате добавления метанола повышается КПД двигателя, а также происходит снижение выбросов вредных веществ выхлопных газов.
Метиловый спирт применяется на всех объектах нефте-газового комплекса в качестве ингибитора - гидратообразования. При добыче газа в районах Крайнего Севера в перекачиваемый газ необходимо добавлять метанол. Это предотвратит закупорку подземных газохранилищ и магистральных газопроводов кристаллогидратами. Образование твердых гидратов газа и связанные с этим пробки в системах газо- и нефтедобычи происходит, когда молекулы воды, образуя вокруг молекул природного газа своего рода клетки, формируют структуру, внешне напоминающую лед. Чаще всего гидратообразованию подвержены такие газы как азот, углекислый газ, сероводород и легкие углеводородные газы (от метана до гептанов). В зависимости от состава газа и давления газогидраты формируются при температуре до 30°С, при которой в газе сохраняются молекулы воды. Применение метанола в качестве ингибитора гидратообразования обусловлено оптимальным набором необходимых свойств, доступностью и дешевизной. В качестве ингибитора для этих целей практически никакое другое вещество не применяется помимо метанола. К тому же метанол тщательно исследован как ингибитор гидратообразования, и в технической литературе всегда можно найти разнообразные характеристики и необходимые данные, чтобы произвести расчет технологического процесса использования для этих целей метанола. Так как объемы добычи газа в данных районах будут увеличиваться год от года, возрастает колоссальный спрос на метанол. В связи с удорожанием поставок метанола (вдвое, а то и втрое), особенно на полуостров Ямал, где возможность его доставки практически отсутствует, появляется необходимость в создании малотоннажных легко транспортируемых установок для производства метилового спирта в районах добычи газа.
Необходимо помнить, что метанол - очень ядовитое вещество, помимо раствора, пары его также ядовиты, температуры вспышки его паров составляет 8°С, поэтому необходимо следовать инструкциям по безопасности, особенно на объектах газовой промышленности. На данных объектах метанол разрешено использовать как средство разрушения или предотвращения кристаллогидратных пробок в приборах, аппаратах, газопроводах. Метанол используют для обработки в газовых скважинах призабойных зон.
Несмотря на имеющиеся у метилового спирта недостатки (ядовитость, невысокая теплота сгорания, высокая температура вспышки, гигроскопичность), имеются неоспоримые достоинства в применении метанола (пожарная и экологическая безопасность, предсказуемость при сжигании, наличие кислорода в молекуле, энергетическая эффективность).
В перспективе использование метанола возможно в различных химических генераторах электрической энергии (как носителя кислорода). Это направление только разрабатывается, и его разработка и внедрение технологий такого рода использования метанола следует ожидать на протяжении ближайших трех десятилетий. Но в тоже время полученные на сегодня опыты, результаты, научные разработки по использованию метанола, по мнению ученых, с уверенностью дают понять, что метанол – это топливо будущего.
39) Технологический процесс получения метанола из оксида углерода и водорода включает ряд операций, обязательных для любой технологической схемы синтеза. Газ предварительно очищается от карбонила железа, сернистых соединений, подогревается до температуры начала реакции и поступает в реактор синтеза метанола. По выходе из зоны катализа из газов выделяется образовавшийся метанол, что достигается охлаждением смеси, которая затем сжимается до давления синтеза и возвращается в процесс.
Технологические схемы различаются аппаратурным оформлением главным образом стадии синтеза, включающей основной аппарат колонну синтеза и теплообменник [1].
На рисунке 1.2 представлена схема агрегата синтеза метанола под давлением 5.5 МПа
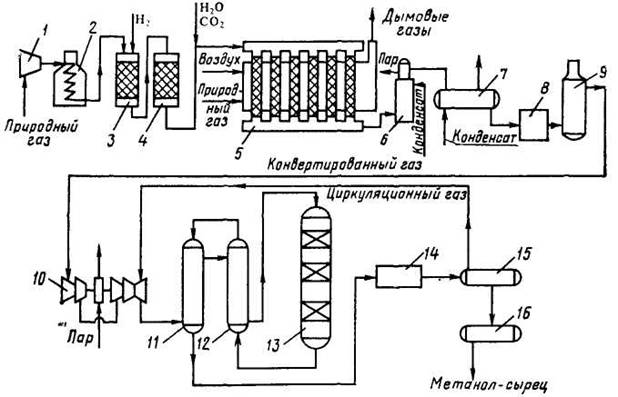
Рисунок 1.2 – Схема производства метанола при давлении 5 МПа
1, 10 – турбокомпрессоры; 2 – подогреватель природного газа; 3 – реактор гидрирования сернистых соединений; 4 – адсорбер; 5 – трубчатый конвертор; 6 – котел-утилизатор; 7, 11, 12 – теплообменники; 8, 14 – холодильники (АВО); 9, 15 – сепараторы; 13 – колонна синтеза; 16 – сборник
Природный газ сжимается турбокомпрессором 1 до давления 3 МПа, подогревается в подогревателе 2 за счет сжигания в межтрубном пространстве природного газа и направляется на сероочистку в аппараты 3 и 4, где последовательно осуществляется каталитическое гидрирование органических соединений серы и поглощение образующегося сероводорода адсорбентом на основе оксида цинка. После этого газ смешивается с водяным паром и диоксидом углерода в соотношении СН4: Н2О: СО2 = 1: 3,3: 0,24. Смесь направляют в трубчатый конвертор 5, где на никелевом катализаторе происходит пароуглекислотная конверсия при 850-870 °С. Теплоту, необходимую для конверсии, получают в результате сжигания природного газа в специальных горелках.
Конвертированный газ поступает в котел-утилизатор 6, где охлаждается до 280–290 °С. Затем теплоту газа используют в теплообменнике 7 для подогрева питательной воды, направляемой в котел-утилизатор. Пройдя воздушный холодильник 8 и сепаратор 9, газ охлаждается до 35-40 °С.
Охлажденный конвертированный газ сжимают до 5 МПа в компрессоре 10, смешивают с циркуляционным газом и подают в теплообменники 11, 12, где он нагревается до 220–230 °С.
Нагретая газовая смесь поступает в колонну синтеза 13, температурный режим в которой регулируют с помощью холодных байпасов. Теплоту реакционной смеси используют в теплообменниках 11, 12 для подогрева поступающего в колонну газа.
Далее газовая смесь охлаждается в холодильнике-конденсаторе 14, сконденсировавшийся метанол-сырец отделяется в сепараторе 15 и поступает в сборник 16. Циркуляционный газ возвращают на синтез, продувочные и танковые газы передают на сжигание в трубчатую печь.
Вследствие снижения температуры синтеза при низком давлении процесс осуществляется в условиях, близких к равновесию, что позволяет увеличить производительность агрегата.
Принимаем для проектирования технологическую схему синтеза метанола при низком давлении (5,5 МПа).
40) Скоростью химической реакции называется количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
Количество вещества выражают в МОЛЯХ, а объем в ЛИТРАХ. В этом случае мы получаем удобную для работы величину - КОНЦЕНТРАЦИЮ вещества в моль/л, которая ИЗМЕНЯЕТСЯ в ходе реакции.
Таким образом, скоростью реакции называют изменение концентрации какого-нибудь вещества, участвующего в реакции, за единицу времени (например, за секунду или за минуту). Отсюда другое определение скорости реакции:
Скоростью химической реакции называется ИЗМЕНЕНИЕ КОНЦЕНТРАЦИИ реагента или продукта в единицу времени.
Разницу между тем, что было и тем, что стало, часто обозначают буквой греческого алфавита Δ (дельта) Следовательно, только что приведенное определение математически можно выразить так:
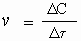
где v - скорость реакции, ΔC - изменение концентрации (в моль/л), а Δτ - интервал времени, в течение которого это изменение произошло (сек). Следовательно, размерность у скорости реакции такая: "моль/л.сек".
41)
42) Скорость реакции - это величина, показывающая как изменяется концентрация одного из веществ в единицу времени.
Чтобы ускорить достижение состояния равновесия, требуется увеличить скорость реакции. Основными способами увеличения скорости реакции является повышение температуры, изменение концентрации, введение катализатора.
1.Влияние температуры. Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,
| химические реакции при высоких температурах протекают быстрее, чем при низких температурах |
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:
| при повышении температуры на 10 0С скорость химической реакции возрастает в два - четыре раза. |
Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа:

|
Правило Вант - Гоффа является приближенным и применимо лишь для ориентировочной оценки влияния температуры на скорость реакции.
2.Влияние катализатора. Катализаторы - это вещества, которые повышают скорость химической реакции. Они вступают во взаимодействие с реагентами с образованием промежуточного химического соединения и освобождается в конце реакции.
Влияние, оказываемое катализаторами на химические реакции, называется катализом. По агрегатному состоянию, в котором находятся катализатор и реагирующие вещества, следует различать:
гомогенный катализ (катализатор образует с реагирующими веществами гомогенную систему, например, газовую смесь;
гетерогенный катализ (катализатор и реагирующие вещества находятся в разных фазах; катализ идет на поверхности раздела фаз).
3.Влияние концентрации реагирующих веществ. При повышении концентрации хотя бы одного из реагирующих веществ скорость химической реакции возрастает в соответствии с кинетическим уравнением.
Рассмотрим общее уравнение реакции: aA +bB = cC + dD. Для данной реакции кинетическое уравнение принимает вид:

|
Из кинетического уравнения уравнения нетрудно установить смысл коэффициента пропорциональности k, называемый константой скорости реакции. Она численно равна скорости реакции, когда концентрация каждого из реагирующих веществ составляют 1 моль/л. Константа скорости зависит от природы реагирующих веществ, но не зависит от их концентраций.
Дата публикования: 2015-10-09; Прочитано: 521 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
