 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Введение. Тема: «Дегидрирование н-бутана»
|
|
Курсовой проект
Тема: «Дегидрирование н-бутана»
Студент Скоржинская А.Р.
Руководитель Постнов А. Ю.
Оценка за курсовой проект
Дата защиты проекта
Санкт- Петербург
Содержание
Введение
Глава 1
Глава 2
Вывод
Введение
Химическая технология – наука о наиболее экономически и экологически рациональных способах переработки исходных сырьевых материалов в продукты потребления и средства производства.
Химическая технология изучает закономерности протекания химических, теплообменных процессов, способы их проведения, оборудование, в котором осуществляются химико-технологические процессы и как результат разрабатывает оптимальные пути их проведения.
Химическая технология базируется на основах органической и неорганической химии, физической химии, термодинамики, процессов и аппаратов, высшей математики.
Развитие химической промышленности определяется в значительной степени совершенствованием химической техники. Техника химических производств развивается в основном в тех же направлениях, что и в других отраслях промышленности. Главной целью технического прогресса являются:
1)улучшение качества продукции;
2)повышение производительности труда;
3)снижение себестоимости продукции.
Основные взаимосвязанные направления развития химической техники:
1)увеличение масштабов производства, мощностей химико-технологических систем (ХТС) и отдельных аппаратов;
2)интенсификация работы аппаратов;
3)снижение энергозатрат и максимальное использование теплоты химических реакций;
4)уменьшение количества стадий производства и переход к циклическим (замкнутым) системам;
5)замена периодических процессов непрерывными;
6)механизация трудовых операций и автоматизация производства.
Химическая технология классифицируется по различным принципам: 1) по сырью (например, технология переработки минерального, растительного или животного сырья; технология угля, нефти и т.п.); 2) по потребительскому, или товарному, признаку (например, технология удобрений, красителей, фармацевтических препаратов); 3) по группам периодической системы элементов (например, технология щелочных металлов, тяжёлых металлов и др.); 4) по типам химических реакций и процессов (технология хлорирования, сульфирования, электролиза и т.п.).
Развитие химической технологии идёт по пути комплексного использования сырья и энергии в пределах данного производства или в кооперации с др. производствами, конструирования высокопроизводительной аппаратуры из химически стойких материалов, разработки непрерывных и замкнутых («безотходных») процессов, исключающих загрязнение воздушного и водного бассейнов вредными промышленными отходами, расширения диапазонов температур и давлений, использования каталитических реакций, применения процессов в псевдоожиженном слое, развития систем автоматизации, контрольно-измерительной техники и т.п.
Основой нашей курсовой работы является реакция дегидрирования н-бутана, в результате чего образуется н-бутилен—С4Н8, он находит применение в производстверастворителей, служит сырьём для получения высокооктанового моторного топлива, а также в производстве резин и каучуков.
Мы поставили перед собой следующие цели в курсовой работе:
-моделирование процесса дегидрирование бутана
-выбор наиболее выгодного температурного режима
-обеспечение максимальной производительности бутилена
Глава 1
Бутадиен – 1,3 (дивинил) CH2=CH – CH=CH2 - бесцветный газ с характерным запахом, сжигающийся при -5 °С (т. пл. -108.9 С; d4-6(жидк.) =0,65 г /см3; критическая температура 163,1 °С; критическое давление 42,6 ат). Растворимость при 15 °С, г на 100 г растворителя:
в воде…………………………………………………0,13/793 мм рт. ст.
в этаноле……………………………………..………15,0/807 мм рт. ст.
в скипидаре…………………………………………24,1/798 мм рт. ст.
в керосине…………………………………..…….23,1/800 мм рт. ст.
в тетралине………………………………………..…28,6/818 мм рт. ст.
Диеновые углеводороды с сопряженными кратными связями и их производные, например бутадиен-1,3 (дивинил), 2-метилбутадиен-1,3 (изопрен), 2-хлорбутадиен-1,3 (хлоропрен) и другие, обладают повышенной по сравнению с моноолефинами активностью в реакциях присоединения вообще и в реакциях полимеризации в особенности.
Бутадиен-1,3 CH2=CH – CH=CH2 является одним из важнейших мономеров для производства синтетических каучуков и латексов, бутадиен находит некоторое применение в производстве пластмасс и в органическом синтезе.
Известно много способов получения бутадиена-1,3:
1) каталитическое превращение этилового спирта по методу С.В. Лебедева и по методу И.И. Остромысленского;
2) выделение из газов высокотемпературного пиролиза нефтяных дистиллятов;
3) синтезы на основе ацетилена через ацетальдоль и через бутиндиол;
4) взаимодействие формальдегида с пропиленом с последующей дегидратацией 4-метил-1,3-диоксана;
5) каталитическое дегидрирование н -бутана и н -бутиленов.
В настоящее время одним из основных технических способов производства бутадиена-1,3 является дегидрирование н -бутана или н -бутилена. Огромные количества бутана, получаемого при прямой гонке и крекинге нефти, а также при стабилизации газового бензина, представляют собой практически неограниченные ресурсы сырья для промышленности синтетического каучука. Технологический процесс дегидрирования бутана или бутиленов освоен в крупных промышленных масштабах.
Процесс получения бутадиена-1,3 дегидрирования углеводородов С4 осуществлен в промышленности по трем вариантам:
1)двухступенчатое дегидрирование н -бутана:
CH3– CH2 – CH2–CH3→CH2=CH – CH2–CH3 → CH2=CH–CH=CH
2)одноступенчатое дегидрирование н -бутана:
CH3– CH2 – CH2–CH3 →CH2=CH – CH=CH2
3)дегидрирование н -бутиленов.
Двухступенчатое дегидрирование н -БУТАНА.
В качестве сырья для получения н-бутиленов используют бутановую фракцию, выделяемую из газов нефтепереработки или из попутных газов. Бутановую фракцию предварительно очищают от сернистых соединений, а также от изобутана и пентанов. Эти углеводороды выделяют ректификацией. Кроме того, бутан подвергают осушке твердыми поглотителями (прокаленный хлористый кальций, боксит, силикагель, цеолиты) до содержания влаги не более 0,1 вес.%, так как используемый в процессе окисный алюмохромовый катализатор чувствителен к парам воды.
Дегидрирование н-бутана в н-бутилены.
Равновесие обратимого процесса
н-С4Н10 ↔ н-С4Н8 + Н2
с повышением температуры смещается в сторону образования олефинов. Константу равновесия,
К= p(C4H8) * p(H2) / p(C4H10)
а отсюда и равновесную степень превращения н -бутана в интервале 800 – 1200 °С можно рассчитать, исходя из следующих уравнений:
ΔG = 31600 – 33,6* Т
lnK = - ΔG /R * T
При дегидрировании н-бутана образуются α- и β-бутилены
CH3– CH2 – CH2–CH3 → CH2 = CH – CH2 – CH3 (α-бутилен)
CH3– CH2 – CH2–CH3 → CH3 – CH = CH – CH3 (β-бутилен)
причем выход β-бутилена больше, чем α-бутилена. Распределение н-бутиленов в продуктах реакции дегидрирования примерно такое:
34% α-бутилена и 66% β-бутилена (38% транс -изомера и 28% цис -изомера);
оно мало зависит от технологических параметров процесса.
Константа скорости реакции дегидрирования равна 1,55, в то время как константа скорости реакции расщепления составляет К≥ 3, т.е. намного больше. Для значительного увеличения скорости дегидрирования применяют катализаторы.
В качестве промышленных катализаторов применяют окись хрома, осажденную на активной окиси алюминия. Соотношение между хромом и алюминием может колебаться в широких пределах; наиболее распространенными являются катализаторы, содержащие 12–18 % Cr2O3. В зависимости от способа приготовления и условий эксплуатации продолжительность службы катализатора составляет от 4 до 12 месяцев и более. Однако в процессе реакции катализатор быстро зауглероживается и требуется его частая регенерация.
На процесс дегидрирования н -бутана благоприятное действие оказывает понижение давления; при этом увеличивается выход н -бутиленов и уменьшается образование продуктов расщепления бутана по связям С – С
В промышленных условиях процесс каталитического дегидрирования н -бутана с целью получения н -бутиленов для упрощения технологического оформления проводят при атмосферном давлении; реакция не доводится до состояния равновесия, и поэтому степень конверсии бутана на практике не превышает 40 – 50%. Увеличение степени конверсии влечет за собой уменьшение селективности. Так, при 30, 40 и 50% - ной конверсии н-бутана селективность соответственно составляет 84, 76 и 66%.
Глава 2.
Практическая часть.
Математическая модель – это система уравнений, которая устанавливает взаимосвязь между входными и выходными параметрами реактора. Математическая модель реактора должна содержать минимальное количество уравнений при сохранении качественных и количественных характеристик реактора. Математическую модель реактора рассматривают по четырём уровням:
Уравнение материального баланса.
Уравнение теплового баланса.
Кинетическое уравнение (или уравнения, если в реакторе протекает несколько реакций).
Уравнение, описывающее гидродинамическую обстановку в реакторе.
Для упрощения математической модели вводят допущения, которые существенно упрощают математический аппарат, при этом не изменяют сущность рассматриваемого объекта. Применительно к химическому реактору, наибольшую сложность представляют уравнения, описывающие гидродинамическую обстановку в реакторе. Поэтому были созданы модели идеализированных реакторов, в которых характер движения реагентов ограничивается двумя режимами: полного смешения и идеального вытеснения.
Модель идеального вытеснения предполагает, что реактор представляет собой вытянутый канал, то есть один из геометрических размеров которого (длина или высота) много больше другого геометрического размера (диаметра): L>>D или H>>D. Модель идеального вытеснения предполагает «поршневой» режим движения реагентов. То есть поток реагентов можно разбить на N слоёв бесконечно малой длины, каждый из которых продвигается в направлении от входа в реактор к выходу, выталкивая впереди идущий слой. Таким образом, в модели идеального вытеснения запрещено перемешивание в направлении оси потока, но разрешено радиальное перемешивание. В отличие от модели полного смешения, в реакторе идеального вытеснения (РИВ) изменение всех параметров происходит плавно по длине реактора.По модели РИВ могут рассматриваться только проточные реактора.
Дегидрирование бутана проводят в адиабатическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*(PC4H10/PC4H8)*(1-PC4H8*PH2/(PC4H10*Kp)) (м3С4H10/м3*с)
Зависимость константы скорости прямой реакции от температуры:
Lg(K+)=9,6-9050/T
Зависимость константы равновесия от температуры:
lgKp=-6700/T +7.574
Определить наилучший температурный режим реактора полного смешения и производительность по бутену, если исходный состав (мольные доли): бутан 0,1-0,3, бутен 0,01, водород 0,02, остальное – азот, расход смеси 10000-20000 м3/ч, температура смеси на входе в реактор 800-1200 К, давление 0,5-2 Мпа.
С4H10 →C4H8 + H2

|

|

|
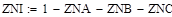
|
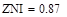
|

|

|
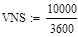
|
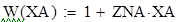
|

|

|
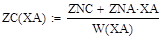
|
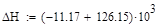
|

|
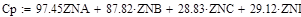
|
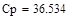
|
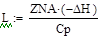
|
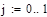
|

|

|

|
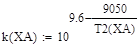
|
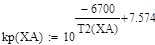
|
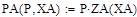
|

|
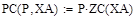
|

|
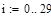
|
|

|

|
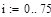
|
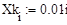
|
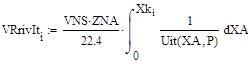
|
|
Так как адиабатический коэффициент нашей задачи имеет отрицательный знак то температура в адиабатическом реакторе будет ниже,а значит константа реакции будет меньше при адиабатическом,чем при изотермическом режиме реактора.Следовательно при одинаковом объёме реактора степень превращения при изотермическом режиме будет выше. Таким образом, выгоднее будет использовать изотермический режим.
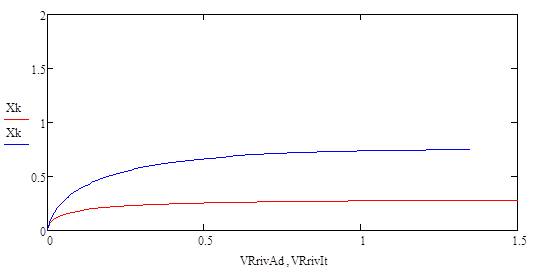
Построим график для производительности:

|

|
На данной графической зависимости видно, что производительность изотермического реактора выше чем адиабатического реактора. Это обусловлено тем, что степень превращения в изотермическом выше чем в адиабатическом реакторе. Следовательно максимальная производительность н-бутилена обеспечивается при использовании изотермического температурного режима.
Дата публикования: 2015-10-09; Прочитано: 1565 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
