 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Тепловой баланс
|
|
В основе уравнения теплового баланса химико-технологического процесса лежит закон сохранения энергии, согласно которому количество теплоты, поступающей в данный процесс (ΣQ')(если в последнем нет превращений ее в другой вид энергии), равно количеству теплоты, выделяющейся в процессе (ΣQ''):
ΣQ'=ΣQ''; (2)
ΣQ'-ΣQ''=0. (2а)
В уравнение теплового баланса (2) химико-технологического процесса входит несколько величин.
В приход:
а) теплота, вносимая входящими в аппарат веществами, - Q1;
б) теплота экзотермических процессов, протекающих в данном аппарате, -Q2;
в)теплота, вносимая за счет подогрева извне, - Q3.
В расход:
г) теплота, уносимая выходящими из аппарата продуктами, - Q4;
д) потери теплоты в окружающую среду, - Q5;
е) теплота эндотермических процессов, протекающих в аппарате, - Q6.
Таким образом, уравнение теплового баланса (2) принимает вид:
Q1+Q2+Q3=Q4+Q5+Q6 (2б)
Подсчет каждой из указанных величин является одной из главных задач расчета теплового баланса химико-технологического процесса.
А) Q1- теплота, вносимая входящими в аппарат веществами, подсчитывается по уравнению:
Q1=MsCs∙t, (3)
где Ms- количество веществ, входящих в процесс (в кг, м3, молях), берут из данных материального баланса. Если значение Ms для газов берется в объемных единицах, то объем газа нужно обязательно привести к нормальным условиям; Cs-средняя теплоемкость исходных веществ. Величину Cs берут из приложений 4 и 5; t- температура исходных веществ при поступлении в процесс. Величина Cs должна быть взята или подсчитана в соответствии с величиной Мs берут в кг, то Cs следует брать в кДж/кг и т.п.
В случае подсчета величины Q1 для системы, состоящей из нескольких компонентов, формула (3) примет вид:
Q1=Мs t (m1c1+m2c2+m3c3+ mncn+) (3a)
Пример 5. Определить количество теплоты Q1 в кдж, которое несут с собой 200 м3 газа (приведенных к н.у.), состоящего из 25% N2 и 75% Н2 при 400ºС, если средняя объемная теплоемкость N2 и Н2 при этой температуре составляет:
C  =
=  1,30 (кДж/м3), а
1,30 (кДж/м3), а
C 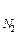 =
= 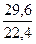 =1,32 (кДж/м3) (см. прил.4).
=1,32 (кДж/м3) (см. прил.4).
Решение. Подставляя имеющиеся данные в уравнение (3а), получим:
А) Q1=200*400*(0,25*1,32+0,75*1,30)=104400 (кДж).
Б) Q2- теплота химических и физических превращений, протекающих в данном процессе. При подсчете Q2 необходимо знать и ясно представлять химические реакции и превращения реагирующих веществ из одного агрегатного состояния в другое. Значение тепловых эффектов реакций, теплоты растворения, испарения берутся из соответствующих таблиц и справочников. Положительные значения величин следует относить к приходу тепла, отрицательные – к расходу.
В) Q3-теплота, подающаяся к аппарату извне, через его стенки (подогрев аппарата горячими газами, сжигание под ним топлива, электроподогрев и т.п.). Эта величина подсчитывается в зависимости от конкретных условий.
Г) Q4- теплота, уносимая уходящими из аппарата продуктами, подсчитывается точно так же, как и количество теплоты Q1.
Д) Q5-тепловые потери в окружающую среду, которые вызываются теплопроводностью стенок аппарата, переходом тепловой энергии в лучистую, конвекцией; подсчитываются по разности приходной и расходной части баланса. Тепловой баланс, так же как и материальный, состоит их двух частей: прихода и расхода, выражается в форме таблицы или диаграммы.
Пример 6. Составить тепловой баланс обжига 1 т влажного колчедана на основе материального баланса (табл. 6) и приведенных ниже данных:
Теплоемкость колчедана –0,13, огарка –0,25 ккал/кг*град; теплоемкость водяного пара –0,36, воздуха –0,31 ккал/м3*град; средняя теплоемкость обжигового газа 0,342 ккал/м3*град; теплопотери печи принимаем равными 25% от прихода тепла; теплота обжига колчедана равна 1285000 ккал. Температура колчедана и воздуха равна 20 ºС, огарка -550 ºС, обжигового газа -680 ºС.
Степень контактирования – 98%. Результаты расчетов выразить в кг и нм3.
Таблица 6
| Приход | Расход | ||||
| Статья прихода | Количество | Статья расхода | Количество | ||
| кг | нм3 | кг | нм3 | ||
| Сухой колчедан Влага с колчеданом Сухой воздух Влага с воздухом | - - 34,6 | Огарок Печной газ В том числе: Сернистый газ Серный ангидрид Кислород Азот Вода | - | ||
| Всего | - | Всего | 4839* | - |
* Превышение расхода над приходом (5 кг) объясняется округлениями цифр при расчетах.
Решение∙
Приход теплоты:
1. Теплота, вносимая сухим колчеданом:
Q1=1000∙0,96∙0,13∙20  2500 (ккал)
2500 (ккал)
2.Теплота, поступающая с сухим воздухом:
Q2=2950*0,31*20  18250 (ккал).
18250 (ккал).
3.Теплота, поступающая с влагой колчедана:
Q3=40*1*20*=800 (ккал).
4.Теплота, поступающая с влагой воздуха:
Q4=34,6*0,36*20=249 (ккал).
5.Теплота обжига (Q5) по условию задачи равна 1285000 ккал.
Общий приход теплоты:
2500+18250+800+249+1285000=1306799 (ккал).
Расход теплоты:
1. Теплота, уносимая с огарком при 550 ºС:
Q6=705∙0,25∙550=96900 (ккал).
2. Теплота, уносимая с обжиговым газом:
Q7=(270+14+221+2335)*0,342*680=660000 (ккал).
3. Теплопотери печи по условию задачи 25% от прихода теплоты:
Q8=1306795.0,25=327000 (ккал)
4. Расход теплоты по вычисленным статьям составляет:
Q9=Q6+Q7+Q8;
Q9=96900+660000+327000=1083900 (ккал).
5. Количество теплоты, которое надо отвести из печи с воздухом, охлаждающим вал:
Q10=1306799-1083900=222899 (ккал).
Составляем тепловой баланс обжига 1 т влажного колчедана (табл.7).
Таблица 7
| Приход | Расход | ||
| Статья прихода | Количество ккал | Статья расхода | Количество ккал |
| С сухим колчеданом С сухим воздухом С влагой колчедана С влагой воздуха От обжига колчедана | С огарком С обжиговым газом Теплопотери С охлаждающим воздухом | ||
| Всего | Всего |
Приложение 1
Плотность некоторых веществ
| Наименование вещества | Плотность | Наименование вещества | Плотность |
| 1.Твердые тела, кг/м3 | |||
| Алюминий | Огнеупоры | 1900-2900 | |
| Медь | Бетон | ||
| Чугун | Древесный уголь | 500-800 | |
| Сталь | Апатит | ||
| Колчедан | Стекло оконное | ||
| Известняк | Стекло органическое | ||
| Песок | Полиэтилен | ||
| Глина(каолин) | Пенопласт | ||
| Каменный уголь | Пробка | ||
| Кокс | Платина | ||
| 2. Жидкости, кг/м3 | |||
| Вода (40С) | Толуол | ||
| Нефть | Ртуть(00С) | ||
| Бензин | Спирт этиловый | ||
| Керосин | Глицерин | ||
| Бензол | Эфир | ||
| 3. Газы, кг/м3 при н.у. Плотность сжиженного газа, кг / л | |||
| азот | 1,25/ 0,81 | окись углерода | 1,25/0,8 |
| аммиак | 0,77/ 0,66 | сернистый газ | 2,93/1,46 |
| воздух | 1,29/0,86 | сероводород | 1,54/0,96 |
| кислород | 1,43/1,14 | углекислый газ | 1,98/1,19 |
| водород | 0,99/0,07 | хлор | 3,21/1,47 |
ЗАДАНИЕ
по теме «Расчет материального баланса»
| Вариант | Производительность печи, т/ч (G H2SO4) | Степень использования серы, т (β) | Расход сухого колчедана, т (β) | Содержание,% | Содержание в воздухе,% | Относительная влажность воздуха,% (φ) | |||||
| Серы в колчедане (Cs) | Влаги в колчедане (Cвл) | Серы в огарке (Cs(ог)) | SO2 в сухом обжиговом газе (C SO2) | SO3 в сухом обжиговом газе(C SO3) | O2 (n) | N2(CN2) | |||||
| 20,88 | 0,815 | 0,79 | 1,0 | 12,0 | 0,1 | ||||||
| 21,16 | 0,910 | 0,79 | 1,2 | 13,0 | 0,1 | ||||||
| 22,00 | 0,765 | 0,81 | 1,4 | 13,2 | 0,1 | ||||||
| 25,10 | 0,750 | 0,82 | 1,6 | 13,4 | 0,1 | ||||||
| 19,60 | 0,630 | 0,83 | 1,0 | 13,6 | 0,1 | ||||||
| 18,38 | 0,815 | 0,84 | 1,2 | 13,8 | 0,1 | ||||||
| 20,91 | 0,910 | 0,79 | 1,4 | 14,0 | 0,1 | ||||||
| 21,16 | 0,765 | 0,81 | 1,6 | 14,1 | 0,1 | ||||||
| 22,00 | 0,883 | 0,82 | 1,0 | 14,2 | 0,1 | ||||||
| 25,10 | 0,885 | 0,83 | 1,2 | 14,3 | 0,1 | ||||||
| 19,60 | 0,885 | 0,84 | 1,4 | 14,4 | 0,1 | ||||||
| 15,00 | 0,885 | 0,79 | 1,6 | 14,5 | 0,1 | ||||||
| 20,10 | 0,885 | 0,81 | 1,0 | 14,6 | 0,1 | ||||||
| 21,30 | 0,815 | 0,82 | 1,2 | 14,0 | 0,1 | ||||||
| 24,00 | 0,910 | 0,84 | 1,4 | 14,1 | 0,1 | ||||||
| 20,00 | 0,765 | 0,78 | 1,6 | 14,2 | 0,1 | ||||||
| 21,60 | 0,750 | 0,79 | 1,0 | 14,3 | 0,1 | ||||||
| 22,00 | 0,630 | 0,82 | 1,2 | 14,4 | 0,1 | ||||||
| 20,82 | 0,970 | 0,81 | 1,4 | 14,0 | 0,1 | ||||||
| 25,10 | 0,630 | 0,84 | 1,6 | 14,3 | 0,1 |
ЗАДАНИЕ
по теме «Расчет теплового баланса»
| Вариант | Теплоемкость | Теплопотери, % | Теплота обжига колчедана, ккал | Температура,0С | |||||||||
| Ккал/кг град | Ккал/м3град | колчедана | воздуха | огарка | обжигового газа | ||||||||
| колчедана | огарка | воздуха | SO2 | SO3 | O2 | N2 | |||||||
| 0,13 | 0,36 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,14 | 0,37 | 0,31 | 0,342 | 0,342 | 0,34 | 0,342 | |||||||
| 0,15 | 0,38 | 0,31 | 0,342 | 0,342 | 0,34 | 0,342 | |||||||
| 0,16 | 0,39 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,17 | 0,40 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,173 | 0,36 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,174 | 0,37 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,13 | 0,38 | 0,31 | 0,342 | 0,342 | 0,34 | 0,342 | |||||||
| 0,14 | 0,39 | 0,31 | 0,342 | 0,342 | 0,34 | 0,342 | |||||||
| 0,15 | 0,40 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,16 | 0,36 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,17 | 0,37 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,12 | 0,38 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,13 | 0,39 | 0,31 | 0,342 | 0,342 | 0,34 | 0,342 | |||||||
| 0,14 | 0,40 | 0,31 | 0,342 | 0,342 | 0,34 | 0,342 | |||||||
| 0,15 | 0,36 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,16 | 0,37 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,17 | 0,38 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,13 | 0,39 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 | |||||||
| 0,14 | 0,40 | 0,31 | 0,342 | 0,342 | 0,34 | 0,341 |
Приложение 2
Атомные массы некоторых элементов
| Прядковый номер (заряд ядра) | Название элемента | Символ | Атомная масса | Прядковый номер (заряд ядра) | Название элемента | Символ | Атомная масса |
| Азот | N | 14,00 | Марганец | Mn | 54,9 | ||
| Алюминий | Al | 26,98 | Медь | Cu | 63,55 | ||
| Аргон | Ar | 39,95 | Молибден | Mo | 95,94 | ||
| Барий | Ba | 137,34 | Мышьяк | As | 74,92 | ||
| Бор | В | 10,81 | Натрий | Na | 22,99 | ||
| Бром | Br | 79,90 | Никель | Ni | 58,71 | ||
| Ванадий | V | 50,94 | Олово | Sn | 118,69 | ||
| Висмут | Bi | 208,98 | Платина | Pt | 195,09 | ||
| Водород | Н | 1,008 | Ртуть | Hg | 200,59 | ||
| Вольфрам | W | 183,85 | Свинец | Pb | 207,19 | ||
| Гелий | He | 4,003 | Сера | S | 32,06 | ||
| Железо | Fe | 55,85 | Серебро | Ag | 107,87 | ||
| Иод | I | 126,90 | Стронций | Sr | 87,62 | ||
| Калий | K | 39,10 | Углерод | С | 12,01 | ||
| Кальций | Са | 40,08 | Фосфор | Р | 30,97 | ||
| Кислород | О | 16,00 | Фтор | F | 19,00 | ||
| Кобальт | Со | 58,93 | Хлор | Cl | 35,45 | ||
| Кремний | Si | 28,09 | Хром | Cr | 52,00 | ||
| Литий | Li | 6,94 | Цинк | Zn | 65,37 | ||
| Магний | Mg | 24,31 | Селен | Se | 78,96 |
Приложение 3
Мольный объем некоторых газов
| Наименование газа | Объем, м3/кмоль | Наименование газа | Объем, м3/кмоль |
| Азот | 22,40 | Окись азота | 22,39 |
| Аммиак | 22,09 | Кислород | 22,39 |
| Аргон | 22,40 | Метан | 22,37 |
| Ацетилен | 22,14 | Окись углерода | 22,40 |
| Воздух | 22,40 | Сернистый газ | 21,89 |
| Водород | 22,43 | Сероводород | 22,16 |
| Водяные пары | 22,12 | Углекислый газ | 22,26 |
| Двуокись азота | 22,37 | Хлор | 22,37 |
Приложение 4
Средняя теплоемкость некоторых газов от 0 до 1100 0С
при нормальном давлении
| Температура, оС | Значение средней молекулярной теплоемкости, кДж/кмоль град | |||||||||
| H2 | O2 | N2 | CO2 | CH4 | H2O H2S | NH3 | NO | SO2 | воздух | |
| 28.8 | 29.3 | 28.4 | 37.7 | 33.4 | 32.5 | 34.7 | 28.5 | 41,2 | 28,6 | |
| 29.0 | 29.6 | 28.7 | 39.2 | 36.6 | 33.2 | 36.2 | 29.0 | 42,4 | 29,0 | |
| 29.1 | 30.1 | 29.0 | 40.6 | 39.8 | 33.8 | 37.8 | 29.5 | 43,5 | 29,3 | |
| 30,0300 | 29.15 | 30.5 | 29.4 | 41.9 | 42.0 | 34.5 | 39.4 | 29.9 | 44,7 | 29,7 |
| 29.2 | 30.9 | 29.6 | 43.2 | 45.5 | 35.1 | 40.8 | 30.3 | 45,8 | 30,0 | |
| 29.3 | 31.3 | 30.0 | 44.4 | 48.3 | 35.6 | 42.3 | 30.6 | 46,6 | 30,3 | |
| 29.4 | 31.8 | 30.3 | 45.5 | 50.9 | 36.0 | 43.7 | 31,0 | 47,5 | 30,6 | |
| 29.5 | 32.0 | 30.6 | 46.5 | 53.5 | 36.6 | 45.1 | 31,3 | 48,5 | 30,9 | |
| 29.6 | 32.3 | 30.8 | 47.5 | 55.8 | 37.5 | 46.4 | 31,6 | 49,3 | 31,2 | |
| 29.7 | 32.7 | 31.1 | 48.5 | 58.1 | 38.0 | 47.6 | 31,9 | 50,0 | 31,4 | |
| 29.8 | 33.0 | 31.4 | 49.3 | 60.2 | 38.6 | 48.8 | 32,2 | 50,6 | 31,7 | |
| 29.9 | 33.4 | 31.6 | 50.1 | 62.4 | 39.1 | - | 32,5 | 50,9 | 31,9 |
Приложение 5
Средняя теплоемкость некоторых газов (м3 газа, приведенного к нормальным условиям) от 0 до 1000 0С
| Температура, 00С | Теплоемкость, ккал/м3 град | |||||
| N2 | O2 | H2O (пар) | Сухой воздух | CO2 | SO2 | |
| 0,310 | 0,312 | 0,356 | 0,311 | 0,387 | 0,414 | |
| 0,311 | 0,315 | 0,359 | 0,312 | 0,411 | 0,433 | |
| 0,312 | 0,324 | 0,367 | 0,315 | 0,449 | 0,467 | |
| 0,318 | 0,335 | 0,378 | 0,321 | 0,479 | 0,494 | |
| 0,324 | 0,347 | 0,390 | 0,328 | 0,503 | 0,514 | |
| 0,327 | 0,350 | 0,397 | 0,331 | 0,514 | 0,521 | |
| 0,330 | 0,354 | 0,403 | 0,334 | 0,523 | 0,529 | |
| 0,333 | 0,356 | 0,409 | 0,337 | 0,532 | 0,531 |
Приложение 6
Средняя теплоемкость некоторых газов, ккал/моль град, при Р =1 атм
| Температура, 00С | Азот | Водород | Кислород | Воздух | Аммиак | Окись азота |
| 6,85 | 6,93 | 7,07 | 6,88 | 8,95 | 6,97 | |
| 7,01 | 6,96 | 7,28 | 6,95 | 9,72 | 7,17 | |
| 7,15 | 7,00 | 7,47 | 7,02 | 10,45 | 7,34 | |
| 7,22 | 7,02 | 7,56 | 7,06 | 10,80 | 7,43 | |
| 7,35 | 7,06 | 7,72 | 7,13 | 11,45 | 7,58 | |
| 7,41 | 7,09 | 7,79 | 7,18 | 11,76 | 7,65 | |
| 7,74 | 7,12 | 7,86 | 7,22 | 12,06 | 7,72 |
Список использованных источников
- Основы химической технологии/ Под ред. проф. И.П. Мухленова.- М.: Высшая школа, 1991.- 463 с.
- Соколов Р.С. Химическая технология. Том 1.- М.: Владос, 2000.- 363 с
- Соколов Р.С. Химическая технология. Том 2.- М.: Владос, 2000.- 442 с
- Общая химическая технология. Часть 1/ Под ред. проф. И.П. Мухленова.- М.: Высшая школа, 1977.- 285с.
- Общая химическая технология. Часть 2/ Под ред. проф. И.П. Мухленова.- М.: Высшая школа, 1977.-261с.
- Решетников П.А., Н.Я. Логинов. Сборник примеров и задач по основам химической технологии.- М.: Просвещение, 1973.- 207с.
Содержание
| Содержание курсовой работы…………………………….. | |
| Материальный баланс…………………………………….. | |
| Тепловой баланс…………………………………………... | |
| Задание по теме «Расчет материального баланса»……... | |
| Задание по теме «Расчет теплового баланса»…………... | |
| Приложение 1. Плотность некоторых веществ…………. | |
| Приложение 2. Атомные массы некоторых элементов… | |
| Приложение 3. Мольный объем некоторых газов……… | |
| Приложение 4. Средняя теплоемкость некоторых газов от 0 до 1100 0С при нормальном давлении……………… | |
| Приложение 5. Средняя теплоемкость некоторых газов (м3 газа, приведенного к нормальным условиям) от 0 до 1000 0С……………………………………………………... | |
| Приложение 6. Средняя теплоемкость некоторых газов, ккал/моль град, при Р =1 атм………………………………… | |
| Список использованных источников……………………. |
Подписано в печать 29.11.2006. Формат 60 х 84 1/16.
Усл.п. л. 1,86. Тираж 40 экз. Заказ № 183
Издательство ВСГТУ. 670013. г. Улан-Удэ, ул. Ключевская, 40,в
Дата публикования: 2015-10-09; Прочитано: 1285 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
