 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Фазовые состояния И превращения углеводородных систем
|
|
В процессе разработки месторождений в пластах непрерывно изменяются давление, температура, количественное соотношение нефти и газа. Это сопровождается изменением состава газовой и жидкой фаз и переходом углеводородов из одной фазы в другую. Особенно быстро такие превращения происходят при подъеме нефти по стволу скважины и движении нефти и газа к потребителю.
Закономерности фазовых переходов и фазовое состояние газонефтяных смесей при различных условиях необходимо знать для решения многих задач.
РАСТВОРЕНИЕ ГАЗОВ В НЕФТИ И ВОДЕ, РАЗГАЗИРОВАНИЕ
Интенсивность выделения газа из нефти в основном зависит от:
- темпа снижения давления и температуры при движении нефтяного потока;
- наличия в составе нефти лёгких углеводородов (С2 – С6);
- молекулярной масса нефти и вязкости нефти;
От количества растворённого в пластовой нефти газа зависят её важнейшие свойства: вязкость, сжимаемость, термическое расширение, плотность и т.д. Способность газа растворяться в нефти и воде имеет большое значение на всех этапах разработки месторождений от добычи нефти до процессов подготовки и транспортировки.
Распределение компонентов нефтяного газа между жидкой и газообразной фазами определяется закономерностями процессов растворения. Процесс растворения идеального газа при небольших давлениях и температурах описывается линейным законом Генри:
 (5.1)
(5.1)
- где Vж – объём жидкости-растворителя; a – коэффициент растворимости газа; Vг – количество газа, растворённого при данной температуре;
- Р – давление газа над поверхностью жидкости.
Коэффициент растворимости газа a показывает, какое количество газа растворяется в единице объёма жидкости при данном давлении:
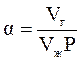 . (5.2)
. (5.2)
Коэффициент растворимости зависит от природы газа и жидкости, давления, температуры.
Давлением насыщения жидкости газом называют минимальное давление, при котором весь газ растворяется в жидкости (т.е. переходит в жидкое состояние)ю Если пластовое давление меньше давления насыщения, то часть газа находится в свободном состоянии (залежь имеет газовую шапку). Если пластовое давление больше давления насыщения, то весь газ растворён в нефти, нефть "недонасыщена" газом.
Природа воды и углеводородов различается, а, следовательно, углеводородная составляющая нефтяного газа растворяется в воде хуже, чем в нефти.
Неуглеводородные компоненты нефтяного газа СО, СО2, Н2S, N2 растворяются в воде лучше (до 5 м3 газа СО и СО2 на 1 т воды).
С повышением давления растворимость газа растёт, а с повышением температуры – падает. Растворимость газа зависит также от минерализации воды.
Разные компоненты нефтяного газа обладают разной способностью растворятся в жидкостях, причём с увеличением молекулярной массы газового компонента растёт коэффициент растворимости.
Количество выделившегося из нефти газа зависит не только от содержания газа в нефти, но и от способа дегазирования. При контактном разгазировании, выделившийся газ остается в контакте с нефтью, а при дифференциальном разгазировании, выделившийся из нефти газ, непрерывно отводится из системы.
Строгое соблюдение условий дифференциального дегазирования затруднено, поэтому используется многократное (ступенчатое) дегазирование.
В процессе добычи нефти встречаются оба способа дегазирования. В начальные периоды снижения давления ниже давления насыщения, когда газ в пласте ещё неподвижен, происходит контактное разгазирование. Затем, по мере последующего выделения газа из нефти, он начинает двигаться к забоям скважин и происходит дифференциальное разгазирование.
Коэффициент разгазирования – количество газа, выделившегося из единицы объёма нефти при снижении давления на единицу.
При движении газа по пласту наблюдается дроссельный эффект – уменьшение давления газового потока при его движении через сужения в каналах. При этом уменьшается температура газа. Интенсивность изменения температуры при изменении давления характеризуется коэффициентом Джоуля-Томсона:
DТ=aDР, (5.3)
где DТ – изменение температуры: a – коэффициент Джоуля-Томсона (зависит от природы газа, давления, температуры); DР – изменение давления.
СХЕМА ФАЗОВЫХ ПРЕВРАЩЕНИЙ ОДНОКОМПОНЕНТНЫХ СИСТЕМ
Индивидуальные углеводородные газы (однокомпонентные системы), изменяют свой объём при изменении давления и температуры. На рис. 7.1 представлена диаграмма фазового состояния для этана. Каждая из кривых (изотерм) соответствует фазовым изменениям при постоянной температуре и имеет три участка. При изотермическом сжатии этана (если его температура меньше критической +33оС_) его объем уменьшается сперва в соответствии с кривой, пока этан не начнет конденсироваться (пока не появится жидкая фаза). Затем сжатие двухфазной системы (этан в газовой и жидкой фазах) идет в соответствии с горизонтальной линией при постоянном давлении пока весь этан перейдет в жидкое состояние. Для уменьшения же объема жидкого этана,естественно, требуется значительное повышение давления (в соответствии с изотермой устремляющейся вверх от ее горизонтальной части).
Пунктирная кривая АСВ характеризует граничные условия фаз (граничная кривая).
Ее часть АС- кривая насыщенной жидкости или точек кипения (парообразования)
Ее часть СВ- кривая насыщенного газа или точек росы (начала конденсации).
Слева от линии АС точек кипения существует только жидкая фаза,.В области справа и сверху от кривой СВ точек конденсации существует только газовая фаза. Горизонтальные участки сплошных кривых, находящиеся ниже АСВ, соответствуют двухфазной газожидкостной области В точке С (критической) пунктирной линии кривые парообразования и конденсации сливаются.
С увеличением температуры (а следовательно и давления для данной системы) изотермы пересекаются с кривой СВ точек росы при все меньших значениях удельного объема, а пересечения их с кривой СА точек кипения происходит при все больших его значениях. То есть с повышением температуры минимальный объем газовой фазы уменьшается, а максимальный объем жидкой фазы увеличивается.
С приближением температуры и давления к критическим значениям свойства газовой и жидкой фаз сближаются, поверхность раздела между ними исчезает, и плотности их уравниваются. Следовательно, с приближением к критической точке С по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара будет непрерывно возрастать.
Изотерма, соответствующая критической температуре (для этана +33оС), является касательной к АСВ в точке С, в которой сходятся линии точек росы и точек кипения. Точка С и является критической точкой для однокомпонентной системы-индивидуального газа этана. Температура и давление в этой точке С(Ркр, Ткр) и называются критическими.

Рисунок 7.1– Диаграмма фазового состояния этана.
Для индивидуальных углеводородов граничным давлением между жидкой и газовой фазой является давление упругости паров (при данной температуре), при котором происходит конденсация или испарение. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара над жидкостью.
Характер изменения объема двух- и многокомпонентных углеводородных газов зависят не только от температуры и давления, но и от состава их смеси.
Фазовые превращения углеводородов можно также представить в координатах давление-температура (рис. 7.2). Для однокомпонентной системы кривая давления насыщенного пара на графике давление-температура является одновременно кривой точек начала кипения и линией точек росы. При всех других давлениях и температурах вещество находится в однофазном состоянии.
Фазовая диаграмма индивидуальных углеводородов ограничивается критической точкой С (рис. 7.2). Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых ещё могут существовать две фазы одновременно.
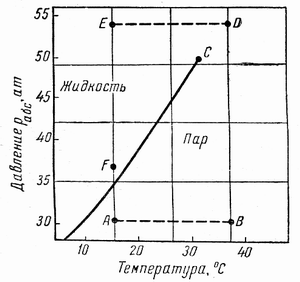
Рисунок 7.2 – Диаграмма фазового состояния этана в координатах Т – Р.
Из рисунка 7.2 следует, что путём соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Газ, характеризующийся параметрами точки А (рис. 7.2), можно изобарически нагреть до температуры точки В, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область точки D, расположенную выше критической точки С, и далее в область точки Е. Свойства системы при этом изменяются непрерывно, и разделения углеводорода на фазы не произойдёт. При дальнейшем охлаждении системы (от точки D до точки Е), а затем при снижении давления до точки F вещество приобретёт свойства жидкости, минуя область двухфазного состояния.
Значительно сложнее закономерности фазовых переходов двух- и многокомпонентных систем.
В смеси углеводородов каждый компонент имеет собственные значения упругости насыщенных паров, поэтому процессы конденсации и испарения не будут проходить при конкретных значениях давления и температуры, а в определённом диапазоне значений давления и температуры. Границы диапазона будут тем больше, чем больше разница между критическими значениями давления и температуры индивидуальных компонентов, входящих в систему. Более подробную информацию по фазовым переходам многокомпонентных систем можно найти в литературе [3, 4].
Дата публикования: 2015-10-09; Прочитано: 2105 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
