 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Понятие о теории переходного состояния. Активированный комплекс
|
|
Энергия активации всегда меньше энергии, которую надо затратить, чтобы разрушить связи в молекулах исходных веществ. Это объясняет теория переходного состояния.
На основании этой теории для протекания реакции необязательно полностью разрывать химические связи в исходных веществах, достаточно их ослабить. Это происходит при образовании промежуточного соединения – активированного комплекса.
Пример: Реакция синтеза йодистого водорода.
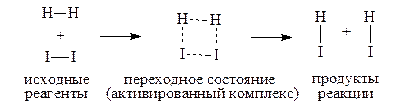
Активные молекулы Н2 и I2 объединяются в промежуточный активный комплекс Н2¼I2, в котором образование новых связей Н–I идёт одновременно с разрывом связей Н–Н и I–I.
Образование переходного состояния – процесс энергетически более выгодный, чем полное разрушение связей в молекулах исходных веществ. Вот почему образование активированных комплексов характерно для многих реакций, особенно ферментативных.
4. Катализ и катализаторы.
В.И.Слесарев. «Химия. Основы химии живого». стр. 106-107.
Дата публикования: 2015-09-17; Прочитано: 939 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
