 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Заметим, что для реакций 1-го порядка величины a(t) и t0,5 не зависят от начальной концентрации C(0)!
|
|
Задачи
1. н-Бутан при высокой температуре превращается с образованием изобутана, бутена, пропена, этилена, бутадиена, насыщенных газов С1-С3, кокса и т.п. Обоснуйте схему превращений бутана с использованием кинетических данных, т.е. Сi(t). Для обоснования реакции 5, например, построим зависимости: ρ = [C2H4] / [C4H10] от (t) и [C2H4] / [C4H8] от (t)…
Для обоснования реакции 3 построим зависимости: [смол] / [С4Н6] (t) и
[смол] / [С4Н8](t) …
3 2 1 4
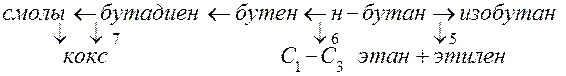
[C2H4]/[C4H10] /[C4H8]
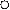  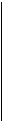  D
D D
D
 D
D D
D
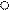
 t t
| 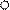 Рис. 5. Изменение относительной селективности образования этилена во времени: - ρ1 = [C2H4]/[C4H10].
D- ρ2 =[C2H4]/[C4H8] Рис. 5. Изменение относительной селективности образования этилена во времени: - ρ1 = [C2H4]/[C4H10].
D- ρ2 =[C2H4]/[C4H8]
|
[смол]/[C4H6] /[C4H8]
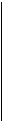 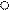  ▼ ▼
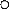 ▼ ▼
 ▼
▼ ▼
▼
0 t |  Рис. 6. Изменение относительной селективности образования смол во времени: -[смол]/[C4H6].
▼-[смол]/[C4H8]. Рис. 6. Изменение относительной селективности образования смол во времени: -[смол]/[C4H6].
▼-[смол]/[C4H8].
|
Видно, что параметр ρ1 = [C2H4] / [C4H10] при малых t стремится к нулю, в отличие от ρ2, следовательно, этилен образуется из бутана, но не из бутена. Аналогично для смол: ρ1 = [смол] / [C4H6] при малых t стремится к нулю, в отличие от ρ2, следовательно, смолы образуются из бутадиена, но не из бутена.
2. Мазут превращается в бензин и газ: МàБàГ. Найти максимальный выход бензина и время максимума, если: k1 = 0,0037 и k2 = 0,0022 с-1
Δk= (k1 - k2)= 0,0015 с-1
yB = (k1/k2)-k2/Δk = (37/22) -22/15 =(1,6818)-1,467= 0,466, т.е. максимальный выход бензина 46,6%.
tmax = ln(k1/k2)/Δk; tmax= 0,51986/0,0015= 346,6 c или 5,78 мин.
3. Найти концентрацию, ограничивающую области протекания двух параллельных реакций: 2-го порядка, k1= 2,5 (М.с)-1 и 0,5-го порядка
k2 = 0,5 М0,5с-1
Сгр = (k2/k1)1/Δm = (0,2M-1,5)1/1,5= 0,342 M,
т.е. при С< 0,342 M преимущественно протекает реакция … порядка, а
при С> 0,342 M преимущественно протекает реакция … порядка
Проверка: r1= 2,5 (М.с)-1.(0,342 M)2= 0,292 M.c
r2= 0,5М0,5с-1.(0,342 M)0,5= 0,292 M.c
4. Найти температуру, ограничивающую области протекания двух параллельных реакций 2-го порядка: 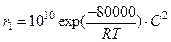 и
и 
Для реакций одинакового порядка
Тгр = ΔЕ / [Rln(k01/k02)] (1)
Тогда Тгр = 40000/[8,314 ln(105)]= 40000/(8,314. 2,303.4)= 522,3К
т.е. при < 522 К преимущественно протекает реакция с Е= …, а
при Т> 522К преимущественно протекает реакция с Е= …
5. Найти константу скорости реакции, имеющей 2й порядок, если время полупревращения 20 мин и начальная концентрация реагента 0,1 М (моль/л).


 (3)
(3)
В ур. (3) вводим: t= 20 мин; С(0)= 0,1 М и С(t1/2)= 0,05 M.
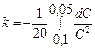 =-0,05│
=-0,05│ 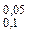 (-С)-1= 0,05мин-1.(1/0,05М –1/0,1М)= 0,5М-1мин-1
(-С)-1= 0,05мин-1.(1/0,05М –1/0,1М)= 0,5М-1мин-1
6. Найти объем реактора идеального вытеснения и идеального перемешивания, для обеспечения заданных показателей – степень превращения 80% (или 90%) сырья, подаваемого со скоростью 2500 м3/ч, если константа скорости реакции равна 0,1 с-1. 
Поскольку VR=τ.QA, найдем время контакта в реакторе идеального вытеснения
τ = -ln0,2/0,1= 16,1 с (для х= 90% время контакта 23 с)
VR= 16,1 с. 2500/3600 м3/с = 11,2 м3
для х= 90%: VR= 23. 2500/3600 = 16 м3
Для реактора идеального перемешивания:
τ = х/ 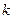 (1-х)= 0,8/(0,1. 0,2)= 40 с (для х= 90% время контакта 90 с)
(1-х)= 0,8/(0,1. 0,2)= 40 с (для х= 90% время контакта 90 с)
VR= 40 с. 2500/3600 м3/с = 27,8 м3 для х= 80%
Дата публикования: 2015-09-17; Прочитано: 244 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!

