 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Гранула перемещается к одному электроду (электрофорез), а ионы диффузионного слоя перемещаются к другому электроду (электроосмос)
|
|
Скорость электрофореза (как и скорость электроосмоса) U может быть вычислена по уравнению:

где 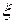 - величина электрокинетического потенциала, возникающая на границе гранулы и диффузного слоя,
- величина электрокинетического потенциала, возникающая на границе гранулы и диффузного слоя,
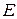 - приложенное напряжение,
- приложенное напряжение,
 - диэлектрическая постоянная дисперсионной среды,
- диэлектрическая постоянная дисперсионной среды,
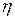 - вязкость золя,
- вязкость золя,
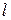 - расстояние между электродами.
- расстояние между электродами.
Любые электролиты, введенные в коллоидный раствор, могут вызвать его коагуляцию. Минимальная концентрация электролита, которая вызывает коагуляцию, называется порогом коагуляции (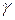 ). На практике порог коагуляции определяется по изменению окраски раствора или по началу выделения дисперсной фазы в осадок.
). На практике порог коагуляции определяется по изменению окраски раствора или по началу выделения дисперсной фазы в осадок.
Коагулирующим действием обладает тот ион электролита, заряд которого противоположен заряду потенциалопределяющих ионов мицеллы, и тем сильнее это выражено, чем выше заряд. Эта закономерность называется правилом Шульца-Гарди.
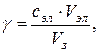
где 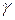 - порог коагуляции,
- порог коагуляции,
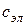 - концентрация введенного электролита,
- концентрация введенного электролита,
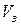 - объем золя,
- объем золя,
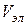 - пороговый объем электролита.
- пороговый объем электролита.
Коллоидные системы характеризуются большей степенью дисперсности, следовательно, поверхностный слой на границе раздела фаз обладает избыточной энергией. Количественной мерой избытка энергии, отнесенной к единице поверхности, является поверхностное натяжение (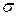 ). Определение поверхностного натяжения можно провести следующими методами:
). Определение поверхностного натяжения можно провести следующими методами:
1) Сравнением высоты поднятия исследуемой и жидкости в капилляре

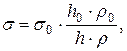
где 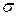 и
и 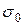 - поверхностные натяжения исследуемой и стандартной жидкостей,
- поверхностные натяжения исследуемой и стандартной жидкостей,
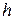 и
и 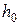 - высоты поднятия в капилляре исследуемой и стандартной жидкостей,
- высоты поднятия в капилляре исследуемой и стандартной жидкостей,
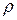 и
и 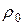 - плотности соответствующих жидкостей.
- плотности соответствующих жидкостей.
2) Измерением давления, при котором происходит проскок газового пузырька из капилляра, опущенного в исследуемую жидкость (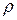 ) и стандартную (
) и стандартную (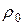 )
)
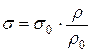 .
.
3) Из подсчета капель исследуемой жидкости(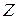 ) и стандартной (
) и стандартной (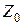 ), вытекающих из одинакового объема через капилляр
), вытекающих из одинакового объема через капилляр
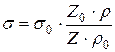 .
.
Величина адсорбции зависит от природы адсорбата и его концентрации (давления), температуры.
Аналитическим выражением изотермы мономолекулярной адсорбции на ровной поверхности на границе фаз жидкость – твердое вещество или газ – твердое вещество является уравнение изотермы Ленгмюра:
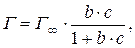
или
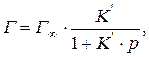
где 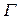 - удельная адсорбция,
- удельная адсорбция,
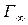 - предельная мономолекулярная адсорбция,
- предельная мономолекулярная адсорбция,
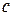 - концентрация адсорбата,
- концентрация адсорбата,
 - давление пара адсорбата,
- давление пара адсорбата,
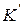 и
и 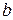 - константы адсорбционного равновесия, характеризующие энергию адсорбции.
- константы адсорбционного равновесия, характеризующие энергию адсорбции.
На практике для вычисления величин адсорбции часто используется эмпирическая формула Фрейндлиха
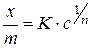 ,
, 
где 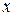 - количество адсорбированного вещества, моль,
- количество адсорбированного вещества, моль,
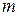 - количество адсорбента, г,
- количество адсорбента, г,
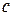 - равновесная концентрация,
- равновесная концентрация,
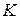 и
и 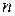 - эмпирические константы.
- эмпирические константы.
Логарифмируя уравнение Фрейндлиха, получаем
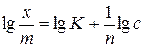
Из графика в координатах 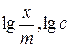 можно определить значения
можно определить значения 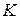 и
и 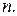
Дата публикования: 2015-07-22; Прочитано: 187 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
