 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Чувствительность реакции
|
|
Чувствительность реакции определяется наименьшим количеством искомого вещества, которое может быть обнаружено данным реактивом в капле раствора (1 мм3).
Чувствительность реакции выражают рядом взаимно связанных величин: открываемым минимумом, минимальной (предельной) концентрацией, предельным разбавлением.
Открываемым минимумом называют наименьшее количество вещества, содержащееся в исследуемом растворе и открываемое данным реактивом при определенных условиях выполнения реакции. Открываемый минимум обычно очень мал, он составляет миллионные доли грамма (0,000001 г == 1 мкг*).
Например, открываемый минимум К+-ионов, осаждаемых платинохлористоводородной кислотой в виде K2[PtCl6] в одной капле анализируемого предельно разбавленного водного раствора (объемом 1 мм3), равен 0,1 мкг.
Минимальная, или предельная, концентрация показывает, при какой минимальной концентрации вещества в растворе данная реакция дает возможность еще открывать обнаруживаемое вещество из определенного объема (например, одной капли) анализируемого раствора.
Численно предельная концентрация представляет собой отношение, которое означает, что в предельно разбавленном растворе, содержащем 1 г открываемых ионов в определенном объеме, данные ионы могут быть обнаружены при помощи избранного реактива в одной капле исследуемого раствора.
Предельное разбавление выражают числом миллилитров водного раствора, содержащего 1 г определяемого вещества, которое открывают при помощи данной реакции (реактива).
Другими словами, предельное разбавление есть величина, обратная предельной концентрации.
Предельное разбавление увеличивается по мере повышения чувствительности реакции.
При рассмотрении динамических состояний равновесия различают гомогенные и гетерогенные системы.
Гомогенными (однородными) системами называют такие системы, физические и химические свойства которых во всех участках системы одинаковы, т.е. системы, состоящие из одной фазы.
Гомогенные системы не имеют поверхностей раздела, отделяющих друг от друга различные содержащиеся в них вещества, отличающиеся по составу или свойствам. Примерами однородных систем являются растворы, Смеси растворимых друг в друге жидкостей, смешанные кристаллы.
Гетерогенными (неоднородными) системами называют системы, состоящие из отдельных частей, различающихся по свойствам и отдельных друг от друга поверхностями раздела, т.е. системы, состоящие из двух или нескольких фаз.
Примерами неоднородных систем могут служить система вода — лед, которая состоит из двух фаз (жидкой — вода и твердой— лед), система насыщенный водный раствор соли (например, BaSО4) —кристаллы той же соли в нем и т. п.
Согласно закону действия масс применительно к аналитическим реакциям, протекающим между определяемым веществом А и реагентом В и сопровождающимся образованием продуктов реакции D и Е:
A+B 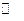 D+E (1)
D+E (1)
при установившемся динамическом (подвижном) химическом равновесии в единицу времени образуется такое количество вещества D и Е, какое в это же время распадается с образованием начальных продуктов А и В.
Таким образом, несмотря на кажущуюся приостановку реакции в момент состояния подвижного равновесия, химическое взаимодействие не прекращается и идет в обоих направлениях — слева направо и справа налево.
В соответствии с уравнением (1) связь между равновесными концентрациями реагирующих веществ выражается уравнением закона действия масс:

При этом символы, заключенные в квадратные скобки [А], [В], [D] и [Е], обозначают равновесные концентрации, т. е. концентрации веществ, принимающих участие в реакции, в момент химического равновесия. Эти концентрации выражаются в молях на литр.
§ 2. Константа равновесия
Подвижное химическое равновесие устанавливается тогда, когда отношение произведения равновесных концентраций конечных продуктов реакции к произведению равновесных концентраций исходных продуктов реакции достигает определенной величины, характерной для данной реакции. Эту величину называют константой равновесия К.
Значение константы равновесия меняется с изменением температуры и давления.
Константа равновесия К определяет относительные количества компонентов, составляющих равновесную систему. Она показывает, что на состояние равновесия влияет каждое из участвующих в реакции веществ. Если изменить концентрацию одного из них, то равновесие нарушится. Чтобы величина К оставалась постоянной, должна измениться концентрация другого компонента данной равновесной системы.
Всякое нарушение равновесия, при неизменных температуре и давлении, вследствие увеличения или уменьшения концентрации одного или нескольких реагирующих веществ, немедленно приводит к новому состоянию равновесия.
Пользуясь константами равновесия, можно теоретически предсказывать и математически рассчитывать направление разнообразных химических реакций, стремящихся к определенному состоянию химического равновесия.
Например, константа равновесия реакции, выражаемой уравнением
A+B 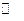 D+E
D+E
равна 10-6, т. е.

Это означает, что произведение равновесных концентраций конечных продуктов реакции в 1000000 раз меньше произведения концентраций исходных продуктов реакции. Следовательно, при К = 10-6 равновесие сдвинуто в левую сторону, т. к. указанная выше реакция практически протекает справа налево.
Если К = 106, то это означает, что произведение концентраций конечных продуктов реакции в 1000 000 раз больше произведения равновесных концентраций исходных продуктов реакции. Следовательно, равновесие в этом случае будет сдвинуто в правую сторону, т. е. указанная выше реакция практически протекает слева направо.
Для реакции
aA+bB 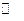 dD+eE
dD+eE
уравнение, выражающее константу равновесия, представляют следующим образом:
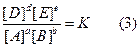
Таким образом, коэффициенты стехиометрического уравнения становятся показателями степени значений концентраций.
В общем виде следствие из закона действия масс в применении к обратимым реакциям можно сформулировать так.
При установившемся состоянии динамического химического равновесия при данных температуре и давлении в обратимой реакции отношение произведения равновесных концентраций конечных продуктов этой реакции к произведению равновесных концентраций исходных продуктов реакции есть величина постоянная. Если коэффициенты а, Ь, d, e не равны единице, то числовые значения концентрации [А], [В], [D] и [Е] должны быть возведены в соответствующие степени.
Закон действия масс широко применяется в аналитической химии. В тех случаях, когда известны константы химического равновесия, закон действия масс и следствие его могут быть использованы для следующих расчетов:
1) равновесных концентраций ионов слабого электролита, образующихся при его диссоциации;
2) равновесных концентраций исходных или конечных продуктов химико-аналитического или химико-технологического процесса?
3) равновесных концентраций ионов водорода и гидроксила истепени электролитической диссоциации электролитов в водных растворах слабых кислот или оснований, буферных смесях, гидролизующихся солей;
4) равновесных концентраций катионов и анионов и растворимости малорастворимых в воде электролитов.
В тех случаях, когда не известны константы химического равновесия, но известны (или определены экспериментальным путем) равновесные концентрации слабых электролитов, закон действия масс может быть использован для расчета их констант равновесия.
ЗАВИСИМОСТЬ МЕЖДУ КОНСТАНТОЙ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ И СТЕПЕНЬЮ ДИССОЦИАЦИИ (ПИСКАРЕВА)
Слабые электролиты можно охарактеризовать константой кислотной или основной электролитической диссоциации и степенью электролитической диссоциации (см. гл. 1, § 12). Если в уравнение константы ввести степени электролитической диссоциации, то можно найти зависимость между этими величинами.
Наиболее легко ее вывести для бинарных электролитов, т.е. таких, которые при диссоциации дают два иона.
Пусть электролит KtAn диссоциирует по уравнению
KtAn⇄Kt+ + An-
Молярную концентрацию электролита обозначим через с, а степень диссоциации—через a. Тогда концентрации в момент равновесия будут для ионов
[Kt+]=[An-]=ca,
для недиссоциированных молекул
[KtAn]=(l-a)c.
Напишем уравнение константы диссоциации для слабого бинарного электролита KtAn:

Подставим в это уравнение значение концентраций ионов и недиссоциированных молекул в момент равновесия:
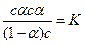
После сокращения получим
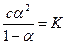
Если степень диссоциации a мала, то данное равенство можно заменить более простым и удобным для расчетов сa2 = К. По последним двум уравнениям можно вычислить степень диссоциации по константе диссоциации для любой концентрации электролита, а также определить константу диссоциации, зная степень диссоциации и концентрацию раствора.
Пример. Константа диссоциации уксусной кислоты равна 1,8•10-5. Определить степень диссоциации 0,1 М раствора кислоты. По уравнению
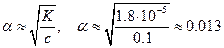
Выразим степень диссоциации в процентах: 0,013•100=1,3%. Это значит, что в 0,1 М растворе СН3СООН из 1000 молекул диссоциируют только 13.
§ 3. Равновесие в гомогенной (однородной) системе. Константа электролитической диссоциации
Рассмотрим в качестве примера диссоциацию уксусной кислоты
CH3COOH  H++CH3COO-
H++CH3COO-
Применяя к данному равновесию закон действия масс, можно написать
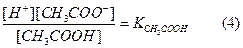
Константу равновесия 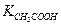 , характеризующую в данном случае состояние электролитической диссоциации уксусной кислоты, называют константой электролитической диссоциации.
, характеризующую в данном случае состояние электролитической диссоциации уксусной кислоты, называют константой электролитической диссоциации.
Константы диссоциации характеризуют силу кислот и оснований. Чем больше значение константы диссоциации, тем больше диссоциация рассматриваемого электролита. Например, азотистая кислота (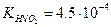 ) сильнее уксусной кислоты (
) сильнее уксусной кислоты (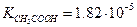 ) и т. д.
) и т. д.
Зная константы электролитической диссоциации кислот и оснований, легко вычислить концентрацию [Н+] и [ОН-] в растворе, степень электролитической диссоциации электролита, степень гидролиза солей, изменения концентраций [Н+] и [ОН-] в процессе нейтрализации слабых кислот и слабых оснований и др.
Расчеты, основанные на применении констант равновесий ионных реакций, дают возможность оценить состояние равновесной системы. При помощи теории ионных равновесий могут быть решены многие вопросы, связанные с выяснением возможности течения данной реакции и преимущественного направления исследуемого процесса.
§ 4. Сравнение констант диссоциации кислот и оснований, понятие о рКА и рКв
Одноосновные кислоты и основания характеризуются одной константой электролитической диссоциации. Для двухосновных и трехосновных кислот и оснований известно более одной константы диссоциации соответственно числу ступеней электролитической диссоциации.
Так, для двухосновной угольной кислоты, диссоциирующей по первой ступени согласно уравнению:
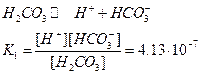
и диссоциирующей по второй ступени:
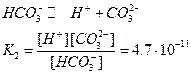
Соответственно диссоциирует по двум ступеням гидроокись свинца:

Как видно из сравнения констант диссоциации угольной кислоты и гидроокиси свинца, первые константы для двухосновных кислот и оснований больше вторых. Это показывает, что двухосновные кислоты и основания диссоциируют по первой ступени сильнее, чем по второй. Следовательно, угольная кислота Н2С03 является более сильной, чем 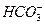 , а Рb(ОН)2 более сильным основанием, чем РbОН+.
, а Рb(ОН)2 более сильным основанием, чем РbОН+.
Очень часто константы диссоциации кислот и оснований выражаются значениями их обратных (т.е. отрицательных) логарифмов, которые обозначают рKA для кислот и рКB для оснований.
Например, 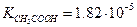 , рKA уксусной кислоты, или р
, рKA уксусной кислоты, или р 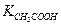 = - lg
= - lg 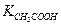 = 5 — lg 1,82 = 5 — 0,26 — 4,74.
= 5 — lg 1,82 = 5 — 0,26 — 4,74.
Соответственно рKA азотистой кислоты представляет собой отрицательный логарифм 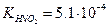 :
:
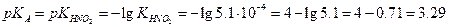
Величины рKA и рКB называют показателями констант диссоциации кислот и оснований соответственно.
Пользование, показателями констант диссоциации вместо самих констант диссоциации, выражаемых числами, возведенными в степень со знаком минус, даёт большие удобства. Сравнивая значения рKA и рКB одноосновных или многоосновных кислот, можно легко судить о силе электролитов. Так, H3PO4 является сильной кислотой, которая в свою очередь сильнее HPO42-, отсюда 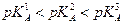 .
.  равен 1,96;
равен 1,96;  т.е.
т.е. 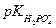 равен 6,7;
равен 6,7;  т.е.
т.е. 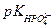 равен 12,44
равен 12,44
§ 9. Равновесие в гетерогенной (неоднородной) системе
Гетерогенные системы имеют очень важное значение в аналитической химии. С такого рода системами приходится сталкиваться в процессе осаждения, отделения, растворения и промывания осадков.
Во время соприкосновения раствора с осадком происходит растворение осадка. По мере пересыщения раствора накапливающееся в нем вещество вновь выпадает в осадок. Схематично процесс может быть представлен следующим образом:
Осадок  Раствор
Раствор
Схема этого равновесного процесса изображена на рис. 38.
В результате взаимно противоположных процессов — осаждения и растворения — между осадком и растворенной частью вещества наступает состояние динамического равновесия, при котором скорость растворения равняется скорости осаждения, т.е. в данном случае происходят процессы, напоминающие обратимые химические реакции с установившимся состоянием химического равновесия (в гомогенной системе).
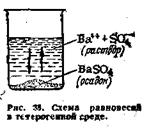 В случае электролитов, помимо указанного процесса растворения — осаждения, происходит еще процесс электролитической диссоциации электролита, перешедшего в раствор.
В случае электролитов, помимо указанного процесса растворения — осаждения, происходит еще процесс электролитической диссоциации электролита, перешедшего в раствор.
Типы осадков. Осадки по внешнему виду могут быть очень разнообразными: творожистые (AgCl), кристаллические (BaSO4), зернистые (PbS04), студенистые [Аl(OH)3], хлопьевидные (As2S3), желатинообразные (H2Si03) и т. п. Однако классификация осадков по их внешнему виду не научна и носит случайный характер, так как одно и то же вещество в зависимости от условий осаждения может образовывать осадки различного вида.
Все осадки по их структуре можно разделить на два типа: кристаллические и аморфные.
Осадки кристаллической структуры внешне отличаются от осадков аморфной структуры тем, что каждое кристаллическое соединение выпадает в определенной, присущей ему кристаллической форме, хорошо различимой иод микроскопом. Форма крупных кристаллов хорошо видна даже невооруженным глазом. При дроблении кристаллов осколки сохраняют ту же структуру.
Внутренняя структура кристаллов характеризуется тем, что молекулы или атомы данного соединения расположены в определенных точках пространства и образуют так называемую кристаллическую решетку. Строение кристаллической решетки изучают при помощи рентгеновских лучей.
Кристаллические осадки в процессе их образования сравнительно быстро оседают и легко отделяются при фильтровании.
Осадки аморфной структуры не обнаруживают под микроскопом частиц определенной формы так как при аморфном строения вещества молекулы его расположены в пространстве беспорядочно и не образуют кристаллической решетки.
Аморфные осадки представляют собой рыхлые, хлопьевидные, студенистые, медленно осаждающиеся массы, обычно очень трудно поддающиеся отделению и промыванию.
Для получения кристаллических осадков требуются одни условия осаждения, для получения аморфных—другие.
В процессе осаждения как кристаллические, так и аморфные осадки способны захватывать примеси. Чистота получаемых осадков зависит от их структуры, от свойств осаждаемого вещества и от условий осаждения.
Главной причиной загрязнения осадков является так называемое сопряженное осаждение.
Сопряженное осаждение (соосаждение) обусловливается склонностью некоторых хорошо растворимых в данном растворителе соединений осаждаться совместно с выпадающими в осадок малорастворимыми соединениями. Например, относительно хорошо растворимая соль MgC204 соосаждается с малорастворимой солью СаС204, a Na2S04 с BaS04 и т. д.
Соосаждение может быть объяснено различными явлениями, например:
1) образованием химических соединений между осаждаемым веществом и присутствующими в растворе примесями;
2) образованием смешанных кристаллов, которые состоят из примесей и основного соединения, кристаллизующихся в одной и той же кристаллической форме;
3) адсорбцией — захватом примесей во время роста кристалл лов основного осаждаемого вещества на поверхности осадка или внутри его частиц (окклюзия) и др.
Адсорбция проявляется у всех твердых веществ, но больше всего она присуща веществам, обладающим относительно большой удельной поверхностью.
Явление адсорбции выражается в стремлении твердых веществ удерживать (поглощать) другие вещества на поверхности раздела двух фаз: твердой (осадка) и жидкой (раствора) или твердой и газообразной. Адсорбция из водных растворов в процессе осаждения осадков связана с увлечением из раствора посторонних ионов. Образующиеся при этом положительно или отрицательно заряженные ионы притягивают из растворов ионы с обратным знаком. 6 результате происходит присоединение молекул. Например, осадок AgCl адсорбирует Сl--ионы из раствора, содержащего Сl--, К+- и NО3-ионы:
(AgCl)n+Cl  [(AgCl)nCl]-
[(AgCl)nCl]-
Образовавшиеся ионы [(AgCl)nCl]- притягивают К+-ионы. В результате осадок основного вещества загрязняется электролитом КСl.
Чем больше адсорбирующая поверхность, тем больше адсорбция примесей, тем больше загрязнение осадка. Поэтому к адсорбции более склонны осадки с развитой поверхностью, т.е. аморфные осадки.
Надежным средством получения чистых осадков является повторное осаждение (переосаждение), заключающееся в растворении полученного осадка и последующем его вторичном осаждении.
При растворении осадка раствор будет содержать лишь те примеси, которые были увлечены при первом осаждении, т. е. незначительные их количества, и после второго осаждения получаются уже относительно чистые осадки. Так, при осаждении оксалата кальция из раствора, содержащего Са2+- и Mg2+-ионы, практически чистый осадок оксалата кальция, не содержащий примеси солей магния, можно получить лишь после переосаждения.
Так как от свойств получаемых осадков в значительной степени зависит точность и надежность аналитических определений, то для получения осадков с требуемыми свойствами следует придерживаться определенных условий осаждения. Строение и свойства образующихся осадков зависят от концентрации осаждаемого вещества и осадителя, продолжительности осаждения, температуры, а также от перемешивания, растворимости образующихся осадков и т. п. (см. книга II, «Количественный анализ»). Например, осадок сульфата бария, осажденного из разбавленных растворов, мелкокристаллический; при осаждении из более концентрированных растворов кристаллический характер осадка менее выражен; в еще более концентрированных растворах мгновенно образуется аморфный осадок. Поэтому следует рассматривать не кристаллические или аморфные вещества, а кристаллические и аморфные состояния, ибо большинство веществ может быть в одних условиях получено в кристаллическом, в других — в аморфном состоянии,
§ 10. Произведение растворимости
Произведение концентрации ионов малорастворймого электро» лита в его насыщенном водном растворе [Ag+] [Сl-] называют произведением растворимости и обозначают знаком ПР с индексом того электролита, о котором идет речь. Например:
[Ag+][Cl-]=ПРAgCl
или в общем виде:
[A][B]=ПРAB=const (12)
Физический смысл уравнения (12) может быть выражен следующим образом.
При установившемся равновесии в насыщенном водном растворе малорастворимого электролита при данной температуре и давлении, независимо от изменения концентраций отдельных ионов, значение ПР остается постоянным.
Например, если в растворе AgCl увеличить концентрацию Ag+-ионов, то соответственно уменьшится концентрация Сl--ионов и наоборот.
В общем виде для малорастворимого электролита AaBb произведение растворимости выражают уравнением;
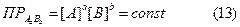
где [А] и [В]—равновесные концентрации катионов и анионов, образующихся при электролитической диссоциации электролита AaBb; а, b — коэффициенты в формуле AaBb.
Если коэффициенты а и Ь не равны единице, значения [А] и [В] должны быть возведены в соответствующие степени. Например:
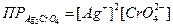
ПР представляет собой ионное произведение, соответствующее насыщенному водному раствору при данной температуре.
 При осаждении из водного раствора какого-либо вещества в виде малорастворимого в воде электролита возникает противоположно направленный процесс — растворение осадка.
При осаждении из водного раствора какого-либо вещества в виде малорастворимого в воде электролита возникает противоположно направленный процесс — растворение осадка.
Неоднородная (гетерогенная) система, состоящая из насыщенного раствора, например хлорида серебра, и соприкасающегося с ним осадка AgCI, может быть в упрощенной форме представлена следующим образом:

Как видно из данной схемы, в растворе хлорида серебра отсутствуют недиссоциированные молекулы AgCI. Другими словами, в водных растворах сильных электролитов существуют только свободные или сольватированные (гидратированные) катионы и анионы. Нужно помнить, что насыщенные водные растворы сильных электролитов состоят лишь из ионов, а динамическое равновесие между осадком и раствором малорастворимого электролита представляется именно указанным выше уравнениям.
При установившемся равновесии в единицу времени выпадает в осадок в виде твердой фазы AgCI столько же ионов серебра и хлора, сколько их переходит в раствор с поверхности осадка AgCI. Независимо от количества осадка AgCI концентрация его в насыщенном растворе остается постоянной.
Математическое выражение, характеризующее процесс осаждения — растворения AgCI можно вывести, исходя из значений скоростей растворения и осаждения малорастворимого электролита. Используя закон действия масс, можно написать, что скорость осаждения AgCI в виде твердой фазы (vi) равна:
v1=K1[Ag+][Cl-]
Скорость растворения AgCI (v2) пропорциональна действующей массе твердого тела (осадка) — [AgCI — осадок], являющийся постоянной величиной:
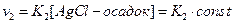
Где К1 и К2 — коэффициенты пропорциональности.
В момент достижения равновесия v1 = v2 и
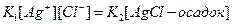
откуда
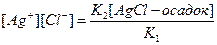
Так как [AgCI—осадок] является величиной постоянной, можно написать:

В ненасыщенном растворе ионное произведение меньше произведения растворимости; поэтому осадок (если он имеется) будет переходить в раствор до тех пор» пока ионное произведение не достигнет значения произведения растворимости.
В пересыщенном растворе ионное произведение превышает произведение растворимости, поэтому осадок будет образовываться до тех пор, пока ионное произведение не станет равным значению произведения растворимости.
Произведение растворимости позволяет учитывать изменение концентрации одних ионов малорастворимого электролита в зависимости от изменения концентрации других.
Обычно значение 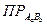 вычисляют по данным растворимости, найденным экспериментальным путем.
вычисляют по данным растворимости, найденным экспериментальным путем.
Правило произведения растворимости имеет большое значение в аналитической химии. Пользуясь им, можно предсказать образование и растворение осадков.
§ 11. Зависимость образования и растворения осадков от значения произведения растворимости
Как правило, электролит начинает выделяться из раствора в осадок тогда, когда его раствор становится пересыщенным. Пересыщение наступает с момента превышения произведением концентраций его ионов произведения растворимости данного малорас-творимого электролита. По мере увеличения концентрации ионов осадителя увеличивается скорость и полнота осаждения электролита; по мере уменьшения концентраций его ионов вещество растворяется. Например, при сильном разбавлении водой.
Таким образом, образование и растворение осадков находится в определенной зависимости от произведения растворимости. Причем растворимость осадков сравниваемых электролитов в воде и в водных растворах других электролитов различна. В чистой воде вещество растворяется, как правило, лучше, чем, например, в растворе, содержащем одноименные с осадком ионы, которые не образуют с ним комплексных соединений.
Зная произведения растворимости сравниваемых между собой однотипных малорастворимых веществ, можно судить о возможности образования осадков и последовательности осаждения из раствора этих веществ при действии соответствующих реагентов. Например, чтобы судить о возможности и последовательности осаждения сульфатов Ва2+, Sr2+, Са2+ и Mg2+-, необходимо обратиться к справочной таблице произведений их растворимости.
Согласно справочным данным:
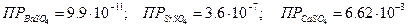
MgS04 является хорошо растворимым соединением; 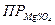 значительно больше произведения растворимости сульфатов всех щелочноземельных металлов и поэтому в справочниках не приводится.
значительно больше произведения растворимости сульфатов всех щелочноземельных металлов и поэтому в справочниках не приводится.
Сравнивая произведения растворимости сульфатов щелочно-земельных элементов, нетрудно заметить, что наименьшее значение ПР имеет BaS04, следовательно, в первую очередь выпадает BaS04, за ним SrS04, потом CaS04; MgS04 остается в растворе.
Однако следует заметить, что, сравнивая произведения растворимости неоднотипных соединений, можно сделать ошибочное заключение. Например, 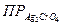 = 10-12 меньше
= 10-12 меньше 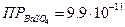 . Однако BaS04 является менее растворимым, чем Ag2CrО4. Дело в том, что о растворимости указанных соединений нельзя судить лишь по значению ПР, так как эти соединения не сравниваемые; они относятся к разным типам.
. Однако BaS04 является менее растворимым, чем Ag2CrО4. Дело в том, что о растворимости указанных соединений нельзя судить лишь по значению ПР, так как эти соединения не сравниваемые; они относятся к разным типам.
Таким образом, о возможности образования осадка лучше судить не по произведению растворимости, а по значению растворимости осадка.
Растворимость малорастворимых веществ в воде: AgCl, BaS04, Ag2Cr04, Са3(Р04)2 и т.д. вычисляют по их произведениям растворимости.
Например, вычислим растворимость AgCl, зная произведение растворимости AgCl, равное 1,7•10-10(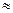 10-10).
10-10).
Согласно уравнению (12)
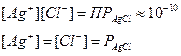
где 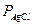 — растворимость AgCl в воде, равная равновесной концентрации ионов серебра [Ag+] или равновесной концентрации ионов [С1-].
— растворимость AgCl в воде, равная равновесной концентрации ионов серебра [Ag+] или равновесной концентрации ионов [С1-].
Растворимость малорастворимых веществ выражают обычно в моль/л (см. гл. II, § 13, стр. 74).
Поскольку 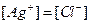 , можно написать:
, можно написать:

Откуда

Следовательно, растворимость бинарного электролита типа AgCl равна квадратному корню из произведения растворимости данного электролита.
Рассуждая аналогичным образом, можно заключить, что растворимость тринарного электролита типа Ag2CrО4 (диссоциирующего на Ag+ + Ag+ + Cr042-) или типа РbСl2 (диссоциирующего: на Pb2+ + Cl- + Cl-) равна:

или
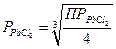
Растворимость малорастворимого электролита типа АаВb вычисляют по формуле:
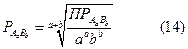
§ 5. Границы применимости закона действия масс
Уравнение (1), выражающее константу равновесия реакции, применимо только для идеальных растворов.
В большинстве случаев реальные растворы дают отклонения от законов для идеальных растворов, так же как это наблюдается и в отношении идеальных и реальных газов. Поэтому при использовании закона действия масс получаются лишь приближенные результаты, но для практических целей в ряде случаев такая точность достаточна.
При концентрациях реагирующих веществ, меньших и незначительно превышающих одномолярные, результаты расчетов, получающиеся в случае применения закона действия масс, для слабых электролитов отклоняются на несколько процентов от действительных. Для сильных электролитов наблюдаются значительные отклонения даже при более низких концентрациях.
Закон действия масс в его классической форме применим только к неэлектролитам и слабым электролитам в разбавленных водных растворах. Все сильные электролиты (щелочи, сильные кислоты, соли) и слабые электролиты в концентрированных водных растворах не подчиняются закону действия масс.
§ 7. Активность
Для более точных расчетов на основе закона действия масс вместо равновесных концентраций пользуются активностями.
Эта величина введена для учета взаимного притяжения ионов, взаимодействия растворенного вещества с растворителем и других явлений, изменяющих подвижность ионов и не учитываемых теорией электролитической диссоциации.
Активность для бесконечно разбавленных растворов равна концентрации:
a = C
Для реальных растворов вследствие сильного проявления межионных сил активность меньше концентрации.
Активность можно рассматривать как величину, характеризующую степень связанности частиц электролита. Таким образом, активность является эффективной (действующей) концентрацией, проявляющей себя в химических процессах в качестве реально действующей массы в отличие от общей концентрации вещества в растворе.
Коэффициент активности. Численно активность равна концентрации, умноженной на коэффициент ¦, называемый коэффициентом активности:
a = C¦
Коэффициент активности является величиной, отражающей все имеющиеся в данной системе явления, вызывающие изменения подвижности ионов, и представляет собой отношение активности к концентрации: ¦ = а/С. При бесконечном разбавлении концентрация и активность становятся равными, а величина коэффициента активности равняется единице.
Для реальных систем коэффициент активности обычно меньше единицы. Активности и коэффициенты активности, отнесенные к бесконечно разбавленным растворам, отмечают индексом (*) и обозначают соответственно а*, ¦*, g*.
Уравнение, применяемое к реальным растворам. Если подставить величину активности вместо величины концентрации данного вещества, в уравнение, характеризующее равновесие реакции, то активность будет выражать влияние этого вещества на состояние равновесия.
Подстановка величин активности вместо значений концентрации в уравнения, вытекающие из закона действия масс, делает эти уравнения применимыми к реальным растворам.
Так, для реакции А + В 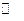 D + E получим:
D + E получим:

или, если подставить значения а = С¦:
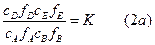
В случае применения уравнений, вытекающие из, закона действия масс, к растворам сильных электролитов и к концентрированным растворам слабых электролитов или к растворам слабых электролитов в присутствии других электролитов необходимо вместо равновесных концентраций подставлять активности. Например, константа электролитической диссоциации электролита типа Кt2Аn3 выражается уравнением:
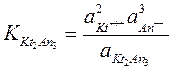
При этом константы электролитической диссоциации, определяемые с помощью активностей, называют истинными или термодинамическими, константами электролитической диссоциации.
Значения коэффициентов активностей.
Зависимость коэффициента активности от различных факторов сложна и её определение встречает некоторые трудности, поэтому в ряде случаев (в особенности в случае растворов слабых электролитов), где не требуется большая точность, в аналитической химии ограничиваются применением закона действия масс в его классической форме.
Значения коэффициентов активности некоторых ионов приведены в табл. 1.
ТАБЛИЦА 1
Приближённые значения средних коэффициентов активности f и разной ионной силе  раствора
раствора
| Заряд иона | Ионная сила, 
| ||||||||
| 0,001 | 0,002, | 0,005 | 0,01 | 0,02 | 0,05 | 0,1 | 0,2 | ||
| 0,97 | 0,95 | 0,93 | 0,90 | 0,87 | 0,81 | 0,76 | 0,70 | ||
| 0,87 | 0,82 | 0,74 1 | 0,66 | 0,57 | 0,44 | 0,33 | 0,24 | ||
| 0,73 | 0,64 | 0,51 | 0,39 | 0,28 | 0,15 | 0,08 | 0,04 | ||
| 0,56 | 0,45 | 0,30 | 0,19 | 0,10 | 0,04 | 0,01 | 0,003 | ||
| Для Н+ | 0,98 | 0,97 | 0,95 | 0,92 | 0,90 | 0,88 | 0,84 | 0,83 | |
| Для ОН- | 0,98 | 0,97 | 0,95 | 0,92 | 0,89 | 0,85 | 0,81 | 0,80 |
Примечание. При расчетах, не требующих большой точности, для ионов Н+ и ОН- можно применять значения средних коэффициентов активности, найденных для однозарядных ионов.
§ 8. Коэффициент активности и ионная сила
Коэффициент активности ионов зависит не только от концентрации данного электролита в растворе, но и от концентрации посторонних ионов, присутствующих в этом растворе. Мерой электрического взаимодействия между всеми ионами в растворе является так называемая ионная сила, величина которой зависит от концентрации и зарядов всех ионов, присутствующих в растворе.
Ионная сила m раствора, содержащего ионы Kt, An и т.п., может быть определена по формуле:
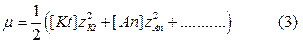
где [Kt], [Аn]-концентрации ионов Kt, An, г-ион/л;
zKt, zAn – заряды ионов.
Или, иначе говоря, ионная сила раствора равна полусумме произведений концентраций ионов на квадраты их зарядов:
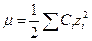
Например, для раствора, содержащего в 1 л 0,01 моль BaCl2 и 0,1 моль NaNO3, ионная сила равна:
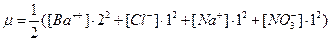
тaк кaк [Cl-] = 2[Ba2+]=2•0,015 г-ион/л, тo

С увеличением ионной силы раствора коэффициент активности уменьшается. Однако, достигнув определенного минимального значения, коэффициент активности при дальнейшем увеличении ионной силы возрастает.
Зависимость коэффициента активности иона от ионной силы очень разбавленного водного раствора электролита выражается следующей формулой Дебая и Хюккеля:
lg¦ = -0,5z2  (4)
(4)
где z — заряд иона.
Зависимость ионной силы от концентрации раствора.
Для сильно разбавленных растворов бинарного электролита (типа Kt+An-), состоящего из однозарядных ионов (NaCI, KC1, NaNO3, KNO3 и т. п.), ионная сила равна:
m = ½([Kt+]·12+[An-]·12)=1/2([Kt+]+[An-])
[Kt+] =[Аn-] = Смол
(Смол — молярная концентрация, иногда ее обозначают С)
m = ½·2смол=с (5)
т.е. ионная сила разбавленных растворов бинарного электролита (типа Kt+An-) равна молярной концентрации электролита. Для электролитов указанного типа
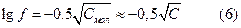
Аналогичным образом можно показать, что для сильно разбавленных растворов электролитов типа KtAn2(BaCl2) и Kt2An(Na2CO3)
m = 3c (7)
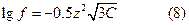
Для электролитов типа Kt++An- - (ZnSO4):

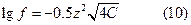
Для электролитов типа Kt+++An3- (AlCl3) и Kt3+An- - - (Na3PO4)
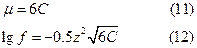
В общем виде для электролита 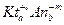 ионную силу раствора можно вычислить по формуле:
ионную силу раствора можно вычислить по формуле:
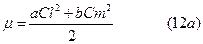
где С- молярная концентрация раствора электролита.
Зависимость коэффициента активности иона от ионной силы очень разбавленного водного раствора электролита выражается следующей формулой Дебая и Хюккеля:
lg¦ = -0,5z2  (4)
(4)
где z — заряд иона.
В общем виде для электролита 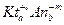 ионную силу раствора можно вычислить по формуле:
ионную силу раствора можно вычислить по формуле:
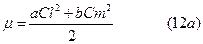
где С- молярная концентрация раствора электролита.
И формула Дебая-Хюккеля будет иметь вид:
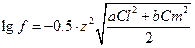
Дата публикования: 2015-07-22; Прочитано: 1862 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
