 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Азотная кислота
|
|
HNO3
Кислотный остаток (NO3)- называется – НИТРАТ
Согласно общей классификации кислот – это:
1). Одноосновная (т.к. имеет в своем составе один атом водорода)
2). Кислородсодержащая (т.к. имеет в своем составе атомы кислорода)
3). Сильная
4). Нелетучая
5). В разбавленном виде – устойчивая (в концентрированном – нет)
Физические свойства.
1). Бесцветная
2). Дымящая на воздухе жидкость
3). Растворимость азотной кислоты в воде не ограничена. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой.
4). Разбавленная – без запаха, концентрированная имеет запах продуктов ее разложения.
Способы получения.
1). Для ее получения, как исходное вещество используют аммиак. И проводят три последовательные превращения:
А. Каталитическое окисление аммиака
4NH3 + 5O2 = 4NO + 6H2O (при нагревании в присутствии платинового катализатора)
Б. Окисление оксида азота (II)
2NO + O2 = 2NO2 (на катализаторе при повышенном давлении)
В. Поглощение оксида азота (IV) водой
4NO2 + 2H2O + O2 = 4HNO3 в случае если не применить кислород, то возможна реакция
2NO2 + H2O = HNO3 + HNO2 (НО! Она неудобна тем, что загрязнена азотистой кислотой)
2). Чистую азотную кислоту получил впервые Иоганн Рудольф Глаубер, действуя на селитру концентрированной серной кислотой:
KNO3 + H2SO4(конц.) (t°) → KHSO4 + HNO3↑
Дальнейшей дистилляцией может быть получена т. н. «дымящая азотная кислота», практически не содержащая воды.
3). Впервые азотную кислоту получили алхимики, нагревая смесь селитры и железного купороса:
4KNO3 + 2(FeSO4 · 7H2O) (t°) → Fe2O3 + 2K2SO4 + 2HNO3↑ + NO2↑ + 13H2O (необязательно для изучения)
Химические свойства.
1). Высококонцентрированная HNO3 - разлагается
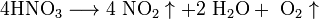
При нагревании азотная кислота распадается по той же реакции. Азотную кислоту можно перегонять (без разложения) только при пониженном давлении (указанная температура кипения при атмосферном давлении найдена экстраполяцией).
2). Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
3). с основными и амфотерными оксидами:
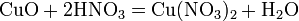
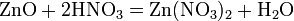
4). с основаниями: (реакция нейтрализации)
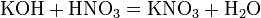
5 ). вытесняет слабые кислоты из их солей: (рекция возможна, если образуется – газ,вода или осадок)
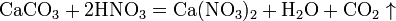
Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
6). с металлами, стоящими в ряду напряжений правее водорода:
- Концентрированная HNO3
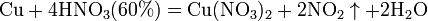
- Разбавленная HNO3
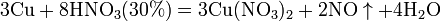
7). с металлами, стоящими в ряду напряжений левее водорода:
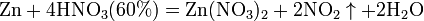
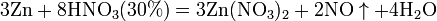

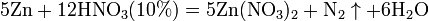
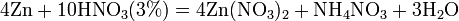
Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты  увеличение активности металла
увеличение активности металла
Продукты взаимодействия железа с HNO3 разной концентрации
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует.
8). Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:
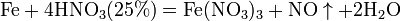
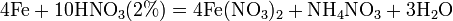
9). Азотная кислота окисляет неметаллы, при этом азот обычно восстанавливается до NO или NO2:
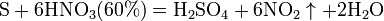
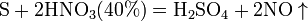
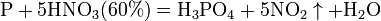

10). сложные вещества, например:
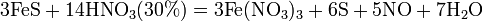
Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Смесь азотной и серной кислот носит название «меланж». Азотная кислота широко используется для получения нитросоединений.
Смесь трех объёмов соляной кислоты и одного объёма азотной называется «царской водкой». Царская водка растворяет большинство металлов, в том числе золото и платину. Её сильные окислительные способности обусловлены образующимся атомарным хлором и хлоридом нитрозила:
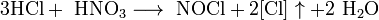
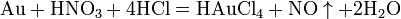
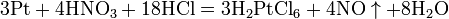
Дата публикования: 2015-07-22; Прочитано: 903 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
