 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Вторичная структура белков. Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействий между функциональными группами
|
|
Вторичная структура белков - пространственная структура, образующаяся в результате взаимодействий между функциональными группами, входящими в состав пептидного остова. При этом пептидные цепи могут приобретать регулярные структуры двух типов: α-спираль и β-структура.
α-Спираль
В данном типе структуры пептидный остов закручивается в виде спирали за счёт образования водородных связей между атомами кислорода карбонильных групп и атомами азота аминогрупп, входящих в состав пептидных групп через 4 аминокислотных остатка. Водородные связи ориентированы вдоль оси спирали (рис. 1-5). На один виток α-спирали приходится 3,6 аминокислотных остатка.
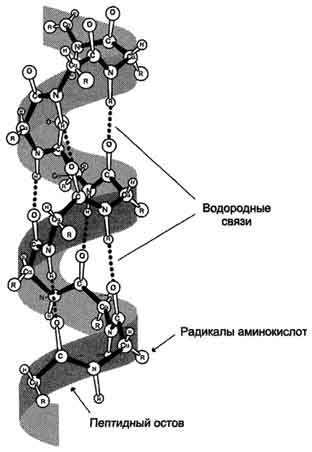
Рис. 1-5. α-Спираль. На рисунке показаны пространственное строение α-спирализованного участка полипептидной цепи и образование водородных связей, участвующих в формировании α-спирали.
В образовании водородных связей участвуют практически все атомы кислорода и водорода пептидных групп. В результате α-спираль "стягивается" множеством водородных связей. Несмотря на то, что данные связи относят к разряду слабых, их количество обеспечивает максимально возможную стабильность α-спирали. Так как все гидрофильные группы пептидного остова обычно участвуют в образовании водородных связей, гидрофильность (т.е. способность образовывать водородные связи с водой) α-спиралей уменьшается, а их гидрофобность увеличивается.
α-Спиральная структура - наиболее устойчивая конформация пептидного остова, отвечающая минимуму свободной энергии. В результате образования α-спиралей полипептидная цепь укорачивается, но если создать условия для разрыва водородных связей, полипептидная цепь вновь удлинится.
Радикалы аминокислот находятся на наружной стороне α-спирали и направлены от пептидного остова в стороны. Они не участвуют в образовании водородных связей, характерных для вторичной структуры, но некоторые из них могут нарушать формирование α-спирали. К ним относят:
· пролин. Его атом азота входит в состав жёсткого кольца, что исключает возможность вращения вокруг -N-CH- связи. Кроме того, у атома азота пролина, образующего пептидную связь с другой аминокислотой, нет атома водорода. В результате пролин не способен образовать водородную связь в данном месте пептидного остова, и α-спиральная структура нарушается. Обычно в этом месте пептидной цепи возникает петля или изгиб;
· участки, где последовательно расположены несколько одинаково заряженных радикалов, между которыми возникают электростатические силы отталкивания;
· участки с близко расположенными объёмными радикалами, механически нарушающими формирование α-спирали, например метионин, триптофан.
β-Структура
β-Структура формируется за счёт образования множества водородных связей между атомами пептидных групп линейных областей одной полипептидной цепи, делающей изгибы, или между разными полипептидными цепями, β-Структура образует фигуру, подобную листу, сложенному "гармошкой", - β-складчатый слой (рис. 1-6).
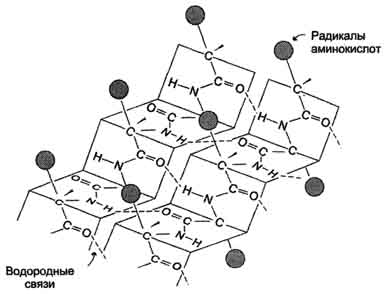
Рис. 1-6. Вторичная структура белков в виде β-складчатого слоя.
Когда водородные связи образуются между атомами пептидного остова различных полипептидных цепей, их называют межцепочечными связями. Водородные связи, возникающие между линейными участками внутри одной полипептидной цепи, называют внутрицепочечными. В β-структурах водородные связи расположены перпендикулярно полипептидной цепи.
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная β-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного β-складчатого слоя (рис. 1-7).
В отличие от α-спиралей, разрыв водородных связей, формирующих β-структуры, не вызывает удлинения данных участков полипептидных цепей.
Как α-спираль, так и β-структуры обнаружены в глобулярных и фибриллярных белках.
Дата публикования: 2015-07-22; Прочитано: 1039 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
