 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Приход тепла от использования угля и ТБО на прогреве лома
|
|
Принимая во внимание, что при прогреве лома сгорает только 50% углерода топлива (уголь + ТБО), в приходе тепла от предварительного подогрева учтено 100% тепла сгоревшей части топлива.
Qнагр = Qуголь + Qтбо; (3.1)
Qуголь = 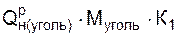 ; (3.2)
; (3.2)
Qтбо = 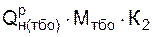 Qнр(тбо)·Mтбо· K2, (3.3)
Qнр(тбо)·Mтбо· K2, (3.3)
где K1, К2 – коэффициенты, учитывающие количество сгоревшего углерода топлива;
Qнагр = 26267,95 · 0,65 · 0,5 + 20845,25 · 0,8 · 0,5 = 16875,2 кДж.
Тепло оставшейся части неокисленного углерода учитывается при расчете химического тепла реакций окисления элементов металлошихты.
3.2.2 Физическое тепло жидкого чугуна
Физическое тепло жидкого чугуна может быть определено по формуле:
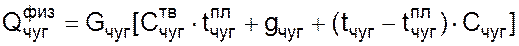 , (3.4)
, (3.4)
где 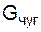 – количество жидкого чугуна в металлической шихте,
– количество жидкого чугуна в металлической шихте, 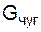 = 70 кг;
= 70 кг;
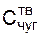 – теплоемкость твердого чугуна, равная 0,75 кДж/кг·град;
– теплоемкость твердого чугуна, равная 0,75 кДж/кг·град;
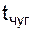 – температура заливаемого в конвертер чугуна,
– температура заливаемого в конвертер чугуна, 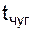 =1420оС;
=1420оС;
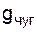 – скрытая теплота плавления чугуна, равная 217,9 кДж/кг;
– скрытая теплота плавления чугуна, равная 217,9 кДж/кг;
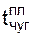 – температура плавления чугуна, принимается в расчете равной 1175°С (в зависимости от химического состава обычно колеблется в пределах 1150-1200°С);
– температура плавления чугуна, принимается в расчете равной 1175°С (в зависимости от химического состава обычно колеблется в пределах 1150-1200°С);
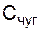 – теплоемкость жидкого чугуна, равная 0,92 кДж/кг·град;
– теплоемкость жидкого чугуна, равная 0,92 кДж/кг·град;
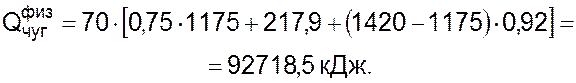
3.2.3 Химическое тепло металлошихты
Значения тепловых эффектов реакций окисления элементов при соответствующих температурах приведены в таблице 18.
Таблица 18 – Значение тепловых эффектов реакций окисления
| Реакция | Тепловой эффект реакции окисления на 1 кг элемента, кДж |
| [C]+{O2}={CO2} | |
| [C]+1/2{O2}={CO} | 10458,2 |
| [Si]+{O2}=(SiO2) | 30913,8 |
| [Mn]+1/2{O2}=(MnO) | 7018,3 |
| 2P+2,5{O2}=(P2O5) | 24327,1 |
| [Fe]+1/2{O2}=(FeO) | 4826,9 |
| 2[Fe]+1,5{O2}=(Fe2O3) | 7374,4 |
На основании данных таблицы 18 и результатов расчета материального баланса может быть определено химическое тепло реакций окисления элементов металлошихты (таблица 19).
Таблица 19 – Химическое тепло реакций окисления элементов металлошихты (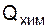 )
)
| Элемент-окисел | Выгорело элементов, кг | Расчет | Вносится тепла, кДж | |
| М.з. | [C]®{CO2} | 0,371 | 0,371 · 34094 | 12660,534 |
| [C]®{CO} | 3,342 | 3,342 · 10458,2 | 34952,120 | |
| [Si]®(SiO2) | 0,480 | 0,480 · 30913,8 | 14838,624 | |
| [Mn]®(MnO) | 0,367 | 0,367 · 7018,3 | 2576,453 | |
| [P]®(P2O5) | 0,126 | 0,126 · 24327,1 | 3077,036 | |
| [Fe]®(FeO) | 1,213 | 1,213 · 4826,9 | 5852,655 | |
| [Fe]®(Fe2O3) | 0,274 | 0,274 · 7374,4 | 2019,827 | |
| [Fe]®(Fe2O3)пыль | 0,600 | 0,600 · 7374,4 | 4424,640 | |
| Итого | 6,773 | Итого | 80401,889 |
3.2.4 Химическое тепло реакций шлакообразования
Считается, что все количество SiO2 ,P2O5 и Fе2О3 в шлаке связано следующими реакциями:
SiO2 + 2СaО = (CaO)2SiO2 + 137432 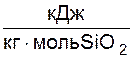 ; (3.5)
; (3.5)
P2O5 + 4CaO = (CaO)4P2O5 + 691350 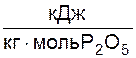 ; (3.6)
; (3.6)
Fe203 + CaO = CaO × Fe203 + 211176 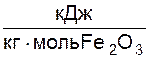 ; (3.7)
; (3.7)
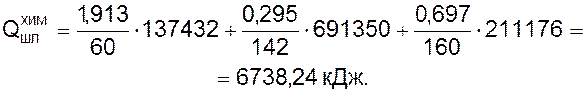
3.2.5 Физическое тепло миксерного шлака
Средняя теплоемкость миксерного шлака может быть определена по формуле:
Co = 0,73 + 0,0003 × 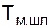 , (3.8)
, (3.8)
где 0,73 – теплоемкость шлака при 0 К, кДж/кг·град;
0,0003 – приращение теплоемкости шлака на 1°, кДж/кг·град;
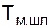 – средняя температура миксерного шлака, К.
– средняя температура миксерного шлака, К.
Среднюю температуру миксерного шлака, попадающего в конвертер из чугуновозного ковша, ориентировочно можно принимать на 15-20° ниже температуры заливаемого в конвертер чугуна.
Тогда:
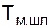 = (1420 - 20) + 273 = 1673 К,
= (1420 - 20) + 273 = 1673 К,
Co = 0,73 + 0,0003 × 1673 = 1,23 кДж/кг·град.
Количество вносимого тепла миксерным шлаком определится из выражения:
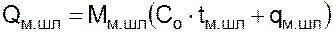 , (3.9)
, (3.9)
где 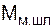 – количество миксерного шлака на 100 кг металлошихты, кг;
– количество миксерного шлака на 100 кг металлошихты, кг;
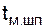 – средняя температура миксерного шлака, °С;
– средняя температура миксерного шлака, °С;
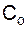 – средняя теплоемкость миксерного шлака, кДж/кг·град;
– средняя теплоемкость миксерного шлака, кДж/кг·град;
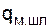 – средняя теплота плавления шлака (209,5 кДж/кг);
– средняя теплота плавления шлака (209,5 кДж/кг);
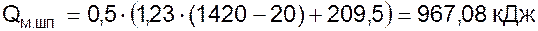 .
.
3.2.6 Общий приход тепла на плавку
Общий приход тепла на плавку рассчитывается следующим образом:
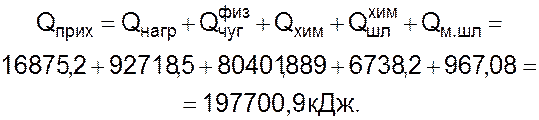
3.3 Расход тепла
3.3.1 Физическое тепло стали
Физическое тепло стали  , может быть определено по уравнению:
, может быть определено по уравнению:
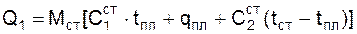 , (3.10)
, (3.10)
где Mст – вес жидкой стали перед раскислением, кг;
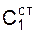 – теплоемкость твердой стали, равная 0,7 кДж/кг·град;
– теплоемкость твердой стали, равная 0,7 кДж/кг·град;
tпл – температура плавления стали, °С;
qпл – скрытая теплота плавления стали, равная 272,4 кДж/кг·град;
tст – температура стали перед выпуском, °С;
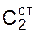 – теплоемкость жидкой стали, равная 0,84 кДж/кг·град.
– теплоемкость жидкой стали, равная 0,84 кДж/кг·град.
Температура плавления стали:
tпл = 1539 – 65 · (%C), (3.11)
где 1539 – температура плавления чистого железа, °С;
65 – снижение температуры плавления стали на 1% углерода в металле, °С;
(%С) – содержание углерода в металле перед раскислением;
tпл = 1539 – 65 · 0,15 = 1529 оС.
Тогда:
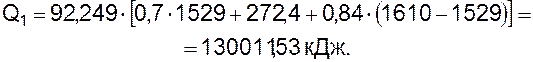
3.3.2 Физическое тепло шлака
Средняя теплоемкость конечного шлака (как и миксерного) определяется по формуле:
Co = 0,73 + 0,0003 × Tшл, (3.12)
где Тшл – температура конечного шлака, К.
По опытным данным температуру конечного шлака можно принять выше температуры металла в конце продувки на 10°С, т.е. 1620°С, так как превышение температуры шлака над температурой металла составляет обычно 5-15°С.
Тогда:
Co = (0,73 + 0,0003 × (1893 + 10 + 273)) = 1,3 кДж/кг·град.
Потери тепла со шлаком определяются по формуле:
Q2 = (Cо × tшл+qшл)Мшл, (3.13)
где qшл – скрытая теплота плавления шлака, равная 209,5 кДж/кг·град;
Мшл – количество конечного шлака, кг;
Q2 = (1,3 × (1610 + 10) + 209,5) × 12,681 = 29319,7 кДж.
3.3.3 Тепло, уносимое отходящими газами
Средняя температура отходящих газов принимается равной средней температуре металла за время продувки:
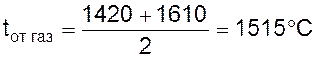 .
.
Средними теплоемкостями газов в зависимости от их температуры обычно задаются в соответствии с таблицей 20.
Таблица 20 – Средние теплоемкости газов
| Компоненты газов | Средняя теплоемкость газов в кДж/(м3∙град) при температурах, °С | Теплоемкость газов при температуре | ||
| CO | 1,47 | 1,48 | 1,49 | |
| CO2 | 2,32 | 2,34 | 2,35 | |
| H2O | 1,82 | 1,84 | 1,85 | |
| N2 | 1,43 | 1,44 | 1,45 | |
| O2 | 1,52 | 1,54 | 1,55 |
Тепло, уносимое отходящими газами, определяется по формуле:
Q3 = tот газ · (CCO × VCO + 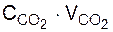 +
+
+ 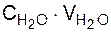 +
+ 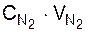 +
+ 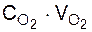 ), (3.14)
), (3.14)
где С – теплоемкости соответствующих составляющих газов, кДж/м3·град;
V – соответственно, количество СО, СО2, H2O, N2, O2 в отходящих газах, м3;
Q3 = 1515 × (1,49 × 6,239 + 2,35 × 0,891 + 1,85 × 0,053 +
+ 1,45 × 0,021 + 1,55 · 0,259) = 18058,52 кДж.
3.3.4 Тепло, уносимое выбросами металла
Количество тепла, уносимого выбросами металла, рассчитывается по формуле:
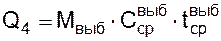 , (3.15)
, (3.15)
где Мвыб – потери металла с выбросами, кг;
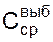 – средняя теплоемкость металла выбросов, которую можно принять равной теплоемкости жидкой стали, т.е. 0,84 кДж/кг·град;
– средняя теплоемкость металла выбросов, которую можно принять равной теплоемкости жидкой стали, т.е. 0,84 кДж/кг·град;
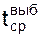 – средняя температура металла выбросов, которую принимают равной средней температуре металла за продувку, т.е. 1515°С.
– средняя температура металла выбросов, которую принимают равной средней температуре металла за продувку, т.е. 1515°С.
Тогда:
Q4=1,000×0,84×1515=1272,6 кДж.
Дата публикования: 2015-07-22; Прочитано: 222 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
