 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Потенциометрия
|
|
Потенциометрия основана на измерении разности электрических потенциалов, возникающих между разнородными электродами, опущенными в раствор с определяемым веществом. Электрический потенциал возникает на электродах при прохождении на них окислительно-восстановительной (электрохимической) реакции. Окислительно-восстановительные реакции протекают между окислителем и восстановителем с образованием окислительно-восстановительных пар, потенциал Е которых определяется по уравнению Нернста
(Еме )обр = Е0 + RT/nF * ln (a Ок/ a восст)
Потенциометрические измерения проводят, опуская в раствор два электрода – индикаторный, реагирующий на концентрацию определяемых ионов, и стандартный электрод или электрод сравнения, относительно которого измеряется потенциал индикаторного. Применяют несколько видов индикаторных и стандартных электродов.
Электроды первого рода – это металл в растворе своих ионов. Они обратимы относительно ионов металла, из которого состоит электрод. Как правило, электроды первого рода чувствительны к катионам.
Электроды второго рода чувствительны к анионам и представляют собой металл М, покрытый слоем нерастворимой его соли МА с анионом, к которому чувствителен электрод. При контакте такого электрода с раствором, содержащим указанный анион, возникает потенциал Е, величина которого зависит от и концентрации аниона [А-] в растворе.
Электродами второго рода являются хлорсеребряный и каломельный. Насыщенные хлорсеребряный и каломельный электроды поддерживают постоянный потенциал и применяют в качестве электродов сравнения, по отношению к которым измеряется потенциал индикаторного электрода.
Окислительно-восстановительные электроды – пластина или проволока, изготовленная из трудноокисляемых металлов – платины, золота, палладия. Сама редокс-система находится в растворе, а инертный металл электрода служит лишь передатчиком электронов между веществами Окис и Восст формами вещества.
Мембранные электроды различного типа имеют мембрану, на которой возникает мембранный потенциал Е. Величина Е зависит от разности концентраций одного и того же иона по разным сторонам мембраны. Простейшим и наиболее употребляемым мембранным электродом является стеклянный электрод.
Ион-селективные электроды - Смешивание нерастворимых солей типа AgBr, AgCl, AgI и других с некоторыми пластмассами (каучуки, полиэтилен, полистирол) привело к созданию ион-селективных электродов, избирательно адсорбирующих из раствора указанные ионы. Так как концентрация определяемых ионов вне электрода отличается от таковой внутри электрода, равновесия на поверхностях мембраны отличаются, что приводит к возникновению мембранного потенциала.
Для проведения потенциометрических определений собирают электрохимическую ячейку из индикаторного электрода сравнения, который опускают в анализируемый раствор и подсоединяют к потенциометру. Применяемые в потенциометрии электроды имеют большое внутреннее сопротивление (500-1000 МОм), поэтому существуют типы потенциометров представляют собой сложные электронные высокоомные вольтметры. Для измерения ЭДС электродной системы в потенциометрах применяют компенсационную схему, позволяющую уменьшить ток в цепи ячейки.
В клинической лабораторной диагностике наиболее часто применяют потенциометры для прямых измерений рН, концентраций других ионов, а также для исследования кислотно-щелочного состояния. Потенциометрические приборы, предназначенные для измерения концентрации различных ионов, называются ионометрами (иономерами).
Ионометры, с помощью которых измеряется концентрация водородных ионов (рН), называются рН-метрами. рН-метры помимо прямых определений рН, pNa, pK, pNH₄, pCl и других позволяют проводить потенциометрическое титрование определяемого иона.
Для измерения рН применяют стеклянный электрод и электрод сравнения – хлорсеребряный. Перед проведением анализов необходимо проверить калибровку рН-метров по стандартным буферным растворам, фиксаналы которых прикладываются к прибору.
Области применения потенциометрии в клинической лабораторной практике

Полярографический метод (вольт-амперометрия)
Сущность метода состоит в изучении зависимости силы тока, протекающего через ячейку, от напряжения (потенциала), приложенного к электродам, находящимся в исследуемом растворе. Величина потенциала обычно изменяется в диапазоне от положительного значения в несколько десятых вольта до отрицательного, примерно до двух вольт. Записанную кривую называют полярограммой и регистрируют прибором – полярографом.
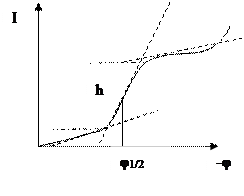 |
На рабочем электроде молекула исследуемого вещества восстанавливается (получает электрон), реже окисляется (теряет электрон), что обеспечивает прохождение электрического тока в цепи. Условия измерения подбирают так, чтобы величина тока определялась скростью диффузии молекул к электроду, т.е. в конечном счете, их концентрацией. Для молекулы каждого вещества характерна пороговая величина электродного потенциала, при которой она может отдать или получить электрон. При достижении этой величины ток в цепи усиливается, так как в процесс включается новый вид молекул или ионов. При постепенном увеличении электрического потенциала происходит характерный рост силы тока в цепи, называемый полярографической волной. Потенциал полуволны является величиной, характерной для данного вещества. Высота полярографической волны пропорциональна концентрации вещества, участвующего на электроде.
На характер полярографической кривой, и, соответственно, силу тока при фиксированном напряжении, влияют не только свойства электрода и состав раствора, но и присутствие катализатора.
Электроды обычно изготавливают из благородных металлов или графита.


Дата публикования: 2015-07-22; Прочитано: 777 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
