 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Общие сведения. Неорганическая химия
|
|
Неорганическая химия
ЛАБОРАТОРНАЯ РАБОТА № 1
Определение химического эквивалента металла
Выполнил: Луговской А.Ю.
Группа: ГС-07-1
Проверил: Иванов И.И.
\
САНКТ-ПЕТЕРБУРГ
Г.
Цель работы - усвоить одно из основных химических понятий – понятий об эквиваленте и научиться определять его количественное значение.
Общие сведения
Эквивалентной массой вещества называется такое его количество, которое соединяется с одним молем атомов водорода, замещает тоже количество атомов водорода в химических реакций или реагирует без остатка с одним эквивалентом любого другого вещества.
Один из основных законов химии – закон эквивалентов: массы веществ, вступивших в реакцию, пропорциональны их химическим эквивалентам.
При проведении расчетов эквиваленты обычно определяются по формуле:
 , где М - молярная масса вещества; z – число эквивалентов в моле, равное:
, где М - молярная масса вещества; z – число эквивалентов в моле, равное:
для элемента – его степени окисления в продукте реакции;
для оксида – удвоенному числу атомов кислорода в формуле;
для гидроксида – числу гидроксильных групп в формуле;
для кислоты – ее основности, то есть числу атомов водорода в формуле кислоты, способных замещаться на металл;
для соли – сумме зарядов всех катионов (или анионов) в формуле соли.
Эквивалентным объемом называют объем, занимаемый при данных условиях эквивалентной массой вещества.
Схема установки:

Обработка результатов эксперимента:
Условия в лаборатории:
m навески металла: 0,0105 г
t=296oК
Ратм= 740 мм.рт.стб.
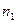 = 22,8 мл
= 22,8 мл
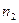 = 8.6 мл
= 8.6 мл
h= 217 мм
Находим давление водорода:
 = Pатм – P1- P2
= Pатм – P1- P2
P1 – Давление столба воды в бюретке.
P2 – Давление паров воды над жидкостью.
Давление насыщенных водяных паров над жидкостью (P2) найдем, опираясь на показания следующего графика:

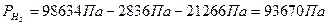
Массу выделившегося водорода вычислим по уравнению Менделеева-Клайперона:
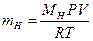 где МН – молярная масса водорода г/моль; V – объем водорода, м3, V= Vизм ∙10-6; R - универсальная газовая постоянная, равная 8,314 дж/моль∙К; Т – температура, в (К)
где МН – молярная масса водорода г/моль; V – объем водорода, м3, V= Vизм ∙10-6; R - универсальная газовая постоянная, равная 8,314 дж/моль∙К; Т – температура, в (К)
MH2 = 0,0124 г/моль
T = 296 K

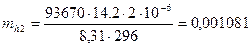
Вычислим эквивалент металла по закону эквивалентов:

Вычислим относительную погрешность эксперимента.
MMg=24,3

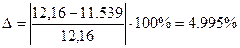
Вывод: эквивалентом элемента называют его весовое количество, соединяющееся с кислородом (8 весовых частей) или с водородом (1,00797 весовых частей). Эквивалент зависит от молярной массы элемента и степени окисления элемента в продукте реакции. В ходе лабораторной работы я вычислил эквивалент, равный 12. В результате я получил погрешность 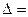 1,31%. Такое значение погрешности обуславливается неточностью измерений и приближенностью расчетов.
1,31%. Такое значение погрешности обуславливается неточностью измерений и приближенностью расчетов.
Дата публикования: 2015-07-22; Прочитано: 157 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
